摘要:我們最重要的DNA修復(fù)系統(tǒng)之一如何識別DNA損傷并啟動修復(fù)的基本機(jī)制。
倫敦醫(yī)學(xué)科學(xué)實驗室(LMS)和劍橋分子生物學(xué)實驗室(LMB)這兩家由英國醫(yī)學(xué)研究委員會(Medical Research Council)核心資助的研究機(jī)構(gòu)的研究人員進(jìn)行了一次優(yōu)雅的合作,解決了一個長達(dá)數(shù)十年的謎團(tuán),這可能為未來更好的癌癥治療鋪平道路。
這項工作揭示了我們最重要的DNA修復(fù)系統(tǒng)之一如何識別DNA損傷并啟動修復(fù)的基本機(jī)制,多年來一直困擾著研究人員。利用尖端成像技術(shù)可視化這些DNA修復(fù)蛋白如何在單個DNA分子上移動,并用電子顯微鏡捕捉它們?nèi)绾巍版i定”特定的DNA結(jié)構(gòu),這項研究為更有效的癌癥治療開辟了道路。

圖1 FANCD2-FANCI調(diào)查DNA并識別雙鏈至單鏈連接
David Rueda教授(LMS)和Lori Passmore博士(LMB)實驗室的研究人員正在合作研究一種DNA修復(fù)途徑,即20多年前發(fā)現(xiàn)的范可尼貧血(Fanconi anemia, FA)途徑。在我們的一生中,DNA不斷受到環(huán)境因素的破壞,包括來自太陽的紫外線、飲酒、吸煙、污染和接觸化學(xué)物質(zhì)。DNA受損的一種方式是當(dāng)它“交聯(lián)”時,它無法正常復(fù)制和表達(dá)基因。為了自我復(fù)制并讀取和表達(dá)基因,DNA雙螺旋的兩條鏈?zhǔn)紫缺仨毥鈮嚎s成單鏈。當(dāng)DNA交聯(lián)時,兩條鏈的“核苷酸”(DNA雙螺旋階梯中的“臺階”)粘在一起,阻止了這種解鏈。
包括交聯(lián)在內(nèi)的DNA損傷的積累會導(dǎo)致癌癥。FA通路在我們的一生中都很活躍,它能識別這些損傷,并不斷修復(fù)它們?;蛲蛔兪惯@一途徑不那么有效的個體更容易患癌癥。雖然參與FA途徑的蛋白質(zhì)在一段時間前就被發(fā)現(xiàn)了,但它們是如何識別交聯(lián)DNA并啟動DNA修復(fù)過程的,仍然是個謎。
來自MRC LMS姊妹機(jī)構(gòu),劍橋LMB的團(tuán)隊,由Lori Passmore領(lǐng)導(dǎo),之前已經(jīng)確定了FANCD2-FANCI (D2-I)蛋白復(fù)合物,它在FA途徑的第一步中起作用,夾在DNA上,從而在交聯(lián)中啟動DNA修復(fù)。然而,關(guān)鍵問題仍然存在:D2-I如何識別交聯(lián)DNA,為什么D2-I復(fù)合體也與其他類型的DNA損傷有關(guān)?
今天發(fā)表在《Nature》雜志上的文章結(jié)合了尖端的科學(xué)技術(shù),展示了D2-I復(fù)合物沿著雙鏈DNA滑動,監(jiān)測其完整性,并且還優(yōu)雅地可視化了它如何識別停止的位置,允許蛋白質(zhì)移動并在該點鎖定在一起,從而啟動DNA修復(fù)。
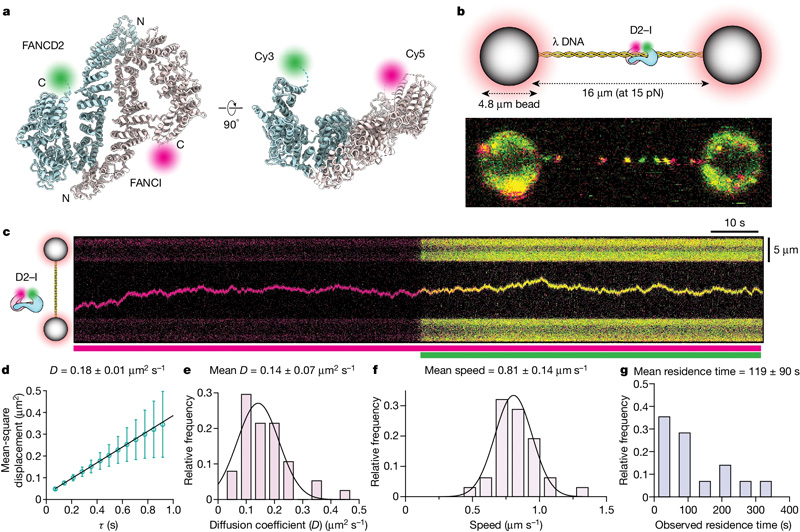
圖2 D2-I鉗在DNA上滑動的單分子成像
David Rueda的單分子成像小組的Artur Kaczmarczyk和Korak Ray與Lori Passmore小組的Pablo Alcón合作,使用了一種稱為“相關(guān)光學(xué)鑷子和熒光成像”的最先進(jìn)的顯微鏡技術(shù)來探索D2-I復(fù)合物如何沿著雙鏈DNA分子滑動。使用光學(xué)鑷子,他們可以在兩個珠子之間捕獲單個DNA分子,這使他們能夠精確地操縱DNA并將其與選定的蛋白質(zhì)孵育。利用熒光標(biāo)記的D2-I和單分子成像,他們觀察了單個D2-I復(fù)合物如何與DNA結(jié)合并沿著DNA滑動,掃描雙螺旋結(jié)構(gòu)。他們發(fā)現(xiàn),F(xiàn)A鉗不是直接識別DNA兩條鏈之間的交聯(lián),而是在到達(dá)單鏈DNA間隙時停止滑動,單鏈DNA間隙是一條DNA鏈缺失的區(qū)域。
利用冷凍電子顯微鏡(一種可以在分子水平上觀察蛋白質(zhì)的強(qiáng)大技術(shù)),研究人員接下來確定了D2-I復(fù)合物在其滑動位置和在單鏈和雙鏈DNA交界處停滯的結(jié)構(gòu)。這表明D2-I與單鏈-雙鏈DNA連接的接觸不同于它單獨與雙鏈DNA的接觸。這使他們能夠識別FANCD2蛋白的一個特定部分,稱為“KR螺旋”,他們在單分子成像實驗中顯示,它對于識別和停止單鏈DNA間隙至關(guān)重要。與LMB PNAC分部的Guillaume Guilbaud和Julian Sale以及荷蘭Hubrecht研究所的Themos Liolios和Puck Knipscheer合作,他們進(jìn)一步證明了D2-I復(fù)合體使用KR螺旋在這些連接處停止的能力對于FA途徑修復(fù)DNA至關(guān)重要。
當(dāng)DNA在我們的細(xì)胞中正常復(fù)制時,它會拆開兩條DNA鏈,并復(fù)制每一條DNA鏈。這就產(chǎn)生了一個“復(fù)制叉”,原始DNA鏈被解開,新的雙鏈DNA在每條鏈上形成。然而,當(dāng)這個分叉到達(dá)DNA交聯(lián)時,這些鏈就不能被解開,從而阻礙了通常的DNA復(fù)制過程。因此,這個停滯的復(fù)制叉包含了暴露的單鏈間隙,DNA已被解開但未被復(fù)制。這項研究表明,D2-I蛋白復(fù)合體緊緊地附著在停滯復(fù)制叉的單鏈和雙鏈DNA之間的這些連接上。這不僅允許D2-I復(fù)合物將其他FA途徑蛋白帶到DNA交聯(lián)中以啟動修復(fù),而且還錨定了剩余的雙鏈DNA,保護(hù)停滯的“復(fù)制叉”免受細(xì)胞內(nèi)酶的破壞,酶會咀嚼DNA鏈暴露的末端,進(jìn)一步破壞DNA。這項工作表明,是DNA內(nèi)的DNA結(jié)構(gòu)由于DNA交聯(lián)而停止,而不是DNA本身,觸發(fā)D2-I復(fù)合體停止滑動并夾緊DNA以啟動修復(fù)。這些停滯的復(fù)制分叉出現(xiàn)在許多類型的DNA損傷中,解釋了D2-I復(fù)合物在其他形式的DNA修復(fù)以及通過FA途徑中的廣泛作用。
了解DNA修復(fù)的過程,更重要的是,為什么它會失敗,具有巨大的重要性,因為DNA損傷是許多疾病的關(guān)鍵因素。關(guān)鍵的是,許多抗癌藥物,例如順鉑,是通過對癌細(xì)胞造成嚴(yán)重的細(xì)胞損傷,使其停止分裂并死亡而起作用的。在這種情況下,DNA修復(fù)途徑——正常生活中如此重要的生理過程——可能被癌細(xì)胞劫持,利用它們來抵抗化療藥物的作用。了解DNA修復(fù)途徑第一步的機(jī)制基礎(chǔ)可能會導(dǎo)致使患者敏感的方法,從而使癌癥藥物在未來更有效。
參考資料
[1] FANCD2–FANCI surveys DNA and recognizes double- to single-stranded junctions
摘要:我們最重要的DNA修復(fù)系統(tǒng)之一如何識別DNA損傷并啟動修復(fù)的基本機(jī)制。
倫敦醫(yī)學(xué)科學(xué)實驗室(LMS)和劍橋分子生物學(xué)實驗室(LMB)這兩家由英國醫(yī)學(xué)研究委員會(Medical Research Council)核心資助的研究機(jī)構(gòu)的研究人員進(jìn)行了一次優(yōu)雅的合作,解決了一個長達(dá)數(shù)十年的謎團(tuán),這可能為未來更好的癌癥治療鋪平道路。
這項工作揭示了我們最重要的DNA修復(fù)系統(tǒng)之一如何識別DNA損傷并啟動修復(fù)的基本機(jī)制,多年來一直困擾著研究人員。利用尖端成像技術(shù)可視化這些DNA修復(fù)蛋白如何在單個DNA分子上移動,并用電子顯微鏡捕捉它們?nèi)绾巍版i定”特定的DNA結(jié)構(gòu),這項研究為更有效的癌癥治療開辟了道路。

圖1 FANCD2-FANCI調(diào)查DNA并識別雙鏈至單鏈連接
David Rueda教授(LMS)和Lori Passmore博士(LMB)實驗室的研究人員正在合作研究一種DNA修復(fù)途徑,即20多年前發(fā)現(xiàn)的范可尼貧血(Fanconi anemia, FA)途徑。在我們的一生中,DNA不斷受到環(huán)境因素的破壞,包括來自太陽的紫外線、飲酒、吸煙、污染和接觸化學(xué)物質(zhì)。DNA受損的一種方式是當(dāng)它“交聯(lián)”時,它無法正常復(fù)制和表達(dá)基因。為了自我復(fù)制并讀取和表達(dá)基因,DNA雙螺旋的兩條鏈?zhǔn)紫缺仨毥鈮嚎s成單鏈。當(dāng)DNA交聯(lián)時,兩條鏈的“核苷酸”(DNA雙螺旋階梯中的“臺階”)粘在一起,阻止了這種解鏈。
包括交聯(lián)在內(nèi)的DNA損傷的積累會導(dǎo)致癌癥。FA通路在我們的一生中都很活躍,它能識別這些損傷,并不斷修復(fù)它們。基因突變使這一途徑不那么有效的個體更容易患癌癥。雖然參與FA途徑的蛋白質(zhì)在一段時間前就被發(fā)現(xiàn)了,但它們是如何識別交聯(lián)DNA并啟動DNA修復(fù)過程的,仍然是個謎。
來自MRC LMS姊妹機(jī)構(gòu),劍橋LMB的團(tuán)隊,由Lori Passmore領(lǐng)導(dǎo),之前已經(jīng)確定了FANCD2-FANCI (D2-I)蛋白復(fù)合物,它在FA途徑的第一步中起作用,夾在DNA上,從而在交聯(lián)中啟動DNA修復(fù)。然而,關(guān)鍵問題仍然存在:D2-I如何識別交聯(lián)DNA,為什么D2-I復(fù)合體也與其他類型的DNA損傷有關(guān)?
今天發(fā)表在《Nature》雜志上的文章結(jié)合了尖端的科學(xué)技術(shù),展示了D2-I復(fù)合物沿著雙鏈DNA滑動,監(jiān)測其完整性,并且還優(yōu)雅地可視化了它如何識別停止的位置,允許蛋白質(zhì)移動并在該點鎖定在一起,從而啟動DNA修復(fù)。

圖2 D2-I鉗在DNA上滑動的單分子成像
David Rueda的單分子成像小組的Artur Kaczmarczyk和Korak Ray與Lori Passmore小組的Pablo Alcón合作,使用了一種稱為“相關(guān)光學(xué)鑷子和熒光成像”的最先進(jìn)的顯微鏡技術(shù)來探索D2-I復(fù)合物如何沿著雙鏈DNA分子滑動。使用光學(xué)鑷子,他們可以在兩個珠子之間捕獲單個DNA分子,這使他們能夠精確地操縱DNA并將其與選定的蛋白質(zhì)孵育。利用熒光標(biāo)記的D2-I和單分子成像,他們觀察了單個D2-I復(fù)合物如何與DNA結(jié)合并沿著DNA滑動,掃描雙螺旋結(jié)構(gòu)。他們發(fā)現(xiàn),F(xiàn)A鉗不是直接識別DNA兩條鏈之間的交聯(lián),而是在到達(dá)單鏈DNA間隙時停止滑動,單鏈DNA間隙是一條DNA鏈缺失的區(qū)域。
利用冷凍電子顯微鏡(一種可以在分子水平上觀察蛋白質(zhì)的強(qiáng)大技術(shù)),研究人員接下來確定了D2-I復(fù)合物在其滑動位置和在單鏈和雙鏈DNA交界處停滯的結(jié)構(gòu)。這表明D2-I與單鏈-雙鏈DNA連接的接觸不同于它單獨與雙鏈DNA的接觸。這使他們能夠識別FANCD2蛋白的一個特定部分,稱為“KR螺旋”,他們在單分子成像實驗中顯示,它對于識別和停止單鏈DNA間隙至關(guān)重要。與LMB PNAC分部的Guillaume Guilbaud和Julian Sale以及荷蘭Hubrecht研究所的Themos Liolios和Puck Knipscheer合作,他們進(jìn)一步證明了D2-I復(fù)合體使用KR螺旋在這些連接處停止的能力對于FA途徑修復(fù)DNA至關(guān)重要。
當(dāng)DNA在我們的細(xì)胞中正常復(fù)制時,它會拆開兩條DNA鏈,并復(fù)制每一條DNA鏈。這就產(chǎn)生了一個“復(fù)制叉”,原始DNA鏈被解開,新的雙鏈DNA在每條鏈上形成。然而,當(dāng)這個分叉到達(dá)DNA交聯(lián)時,這些鏈就不能被解開,從而阻礙了通常的DNA復(fù)制過程。因此,這個停滯的復(fù)制叉包含了暴露的單鏈間隙,DNA已被解開但未被復(fù)制。這項研究表明,D2-I蛋白復(fù)合體緊緊地附著在停滯復(fù)制叉的單鏈和雙鏈DNA之間的這些連接上。這不僅允許D2-I復(fù)合物將其他FA途徑蛋白帶到DNA交聯(lián)中以啟動修復(fù),而且還錨定了剩余的雙鏈DNA,保護(hù)停滯的“復(fù)制叉”免受細(xì)胞內(nèi)酶的破壞,酶會咀嚼DNA鏈暴露的末端,進(jìn)一步破壞DNA。這項工作表明,是DNA內(nèi)的DNA結(jié)構(gòu)由于DNA交聯(lián)而停止,而不是DNA本身,觸發(fā)D2-I復(fù)合體停止滑動并夾緊DNA以啟動修復(fù)。這些停滯的復(fù)制分叉出現(xiàn)在許多類型的DNA損傷中,解釋了D2-I復(fù)合物在其他形式的DNA修復(fù)以及通過FA途徑中的廣泛作用。
了解DNA修復(fù)的過程,更重要的是,為什么它會失敗,具有巨大的重要性,因為DNA損傷是許多疾病的關(guān)鍵因素。關(guān)鍵的是,許多抗癌藥物,例如順鉑,是通過對癌細(xì)胞造成嚴(yán)重的細(xì)胞損傷,使其停止分裂并死亡而起作用的。在這種情況下,DNA修復(fù)途徑——正常生活中如此重要的生理過程——可能被癌細(xì)胞劫持,利用它們來抵抗化療藥物的作用。了解DNA修復(fù)途徑第一步的機(jī)制基礎(chǔ)可能會導(dǎo)致使患者敏感的方法,從而使癌癥藥物在未來更有效。
參考資料
[1] FANCD2–FANCI surveys DNA and recognizes double- to single-stranded junctions



