細胞質(zhì)膜是包圍在細胞表面的一層極薄的膜,也是其生存和發(fā)展的“保護傘”。即使“豪橫”如癌細胞,質(zhì)膜受損也可能會帶來毀滅性的影響。目前,細胞已經(jīng)發(fā)展出快速的修復機制來重新封閉破損的細胞膜,如果能夠了解癌細胞如何從損傷中恢復的機制,或許將為癌癥治療帶來新的突破口。
近日,來自丹麥癌癥協(xié)會研究中心、哥本哈根大學以及南丹麥大學的研究人員在Science Advances發(fā)表了一篇題為Restructuring of the plasma membrane upon damage by LC3-associated macropinocytosis的研究報告,指出癌細胞能夠通過大型胞飲作用(macropinocytosis),“吃掉”細胞受損區(qū)域從而在危急關(guān)頭存活下來。值得注意的是,研究人員還發(fā)現(xiàn)了一種獨特的膜重組機制,這為人們抑制癌細胞的擴散、消滅腫瘤奠定了基礎(chǔ)。

DOI:10.1126/sciadv.abg1969
在進入正題前,需要先介紹一下與細胞損傷及修復有關(guān)的細胞自噬和大型胞飲作用。自噬一種普遍存在于大部分真核細胞中的再循環(huán)系統(tǒng)(recycling system),能夠像“垃圾處理廠”一樣,將細胞內(nèi)受損的結(jié)構(gòu)轉(zhuǎn)化為養(yǎng)分被回收利用。大型胞飲作用則是通過質(zhì)膜皺縮包裹內(nèi)吞物形成大囊泡完成的一種胞吞作用。
先前的研究表明,細胞質(zhì)膜的修復機制依賴于內(nèi)吞、胞吐及膜脫落機制等生物學過程,膜聯(lián)蛋白能夠通過一系列反應促進細胞受損處周圍的質(zhì)膜融合,從而暫時阻止細胞內(nèi)液體的流出。然而,在質(zhì)膜閉合后細胞如何重組受損質(zhì)膜,恢復細胞功能,仍然是未知數(shù)。那么,這個過程是否與細胞自噬有關(guān)呢?
為了揭開細胞修復的背后機制,研究人員使用消融激光造成人乳腺癌細胞MCF7 細胞及宮頸癌細胞HeLa 細胞損傷,結(jié)果發(fā)現(xiàn),細胞能夠在20-30秒內(nèi)重新封閉,并且令人驚訝的是,細胞受損會造成膜褶皺,在此區(qū)域形成兩種與細胞自噬有關(guān)的蛋白質(zhì)囊泡:一種是源于質(zhì)膜受損區(qū)域、與早期內(nèi)吞作用相關(guān)的Rab5陽性大囊泡,大約在質(zhì)膜損傷后2-5分鐘左右開始形成;另一種是出現(xiàn)在修復區(qū)域的表達微管相關(guān)蛋白1輕鏈3(LC3,與自噬相關(guān)的蛋白質(zhì))陽性小囊泡,在細胞受損8~10分鐘時形成。隨著時間的推移,兩種囊泡將在細胞修復區(qū)域共定位,并且似乎融合了。
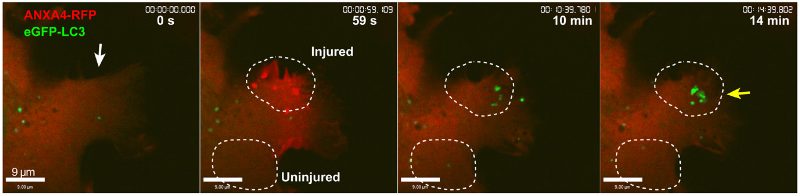
質(zhì)膜受損后出現(xiàn)的LC3小囊泡
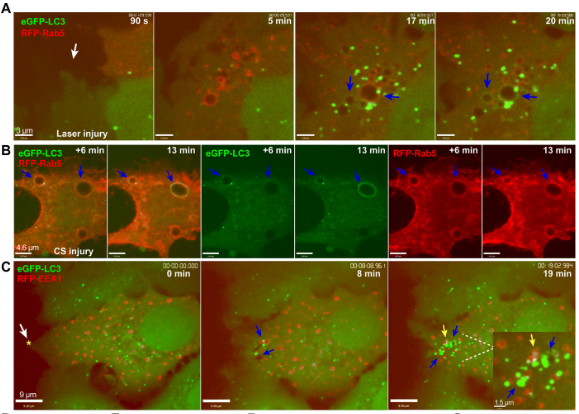
在質(zhì)膜受損處出現(xiàn)的Rab5大囊泡以及兩種囊泡共定位
這些在質(zhì)膜受損后形成的囊泡,究竟承載著怎樣的“使命”?為了探究這個問題,研究人員使用共聚焦延時成像對充滿了細胞外液的Rab5大囊泡的命運進行了跟蹤,觀察結(jié)果表明,這些囊泡后期會自發(fā)收縮,并且這種收縮似乎是受囊泡內(nèi)液體的排除驅(qū)動的。另外, LC3 陽性囊泡隨后似乎將與溶酶體融合,并通過溶酶體降解系統(tǒng)進一步內(nèi)化。
上述情況說明,細胞修復似乎離不開大型胞飲作用。為了驗證這一點,研究人員使用相關(guān)抑制劑處理了相關(guān)細胞,此時細胞修復進程收到顯著影響, LC3 陽性囊泡的形成急劇下降,說明巨胞飲作用在細胞受損后被激活并促進了質(zhì)膜重組,而LC3 囊泡則是為了響應囊泡內(nèi)化而觸發(fā)的。
簡而言之,經(jīng)過消融激光損傷的細胞,能夠?qū)⑼暾募毎だ胧軗p區(qū)域,從而在幾分鐘內(nèi)封閉細胞。隨后,細胞將通過大型胞飲作用將受損區(qū)域以囊泡的形式運送到細胞內(nèi)部進行“回收利用”,如果該過程被阻止,細胞將無法再修復損傷并死亡。
值得注意的是,在這項新研究中,研究人員還發(fā)現(xiàn)的質(zhì)膜修復過程是通過觸發(fā)先前未知非典型自噬過程實現(xiàn)的。通常,細胞自噬是由ULK1/ATG13/ WIPI2通路啟動,但是在這項研究中的細胞卻“不走尋常路”,并且該過程與高度依賴rubicon蛋白的非典型自噬——LC3相關(guān)自噬(LAP)類似,研究人員將這種新發(fā)現(xiàn)的非典型自噬過程稱為與LC3相關(guān)的大型胞飲作用(LAM)。
不僅僅是幫助受損細胞恢復,2020年 Nature Communications 上的一篇文章指出,大型胞飲作用還是腫瘤耐藥的重要原因,而阻斷該過程能夠恢復癌細胞對藥物的敏感性。

doi.org/10.1038/s41467-020-14928-3
總之,這項研究表明,細胞在受損后會觸發(fā)巨胞飲作用來“療傷”。該報告的通訊作者、丹麥癌癥協(xié)會研究中心的Stine Lauritzen Sønder說:“我們認為,癌細胞在質(zhì)膜受損后通過巨胞飲作用恢復的過程或許并不是終點,這可能只是應急措施,之后癌細胞或許進行更徹底的修復,而這或許能夠幫助我們發(fā)現(xiàn)癌細胞的另一個弱點,我們將繼續(xù)探索?!?/div>



