摘要:研究針對胸腺中MHC-I限制性CD8+T細(xì)胞如何獲得不同功能(輔助、細(xì)胞毒、先天記憶)這一核心問題展開。
在我們身體的免疫司令部——胸腺中,未成熟的T細(xì)胞前體經(jīng)歷一場嚴(yán)格的“選拔”才能成為合格的免疫戰(zhàn)士。其中,CD8+T細(xì)胞通常被認(rèn)為是專職的“殺手”細(xì)胞,負(fù)責(zé)清除被病毒感染或癌變的細(xì)胞。然而,免疫系統(tǒng)遠(yuǎn)比我們想象的復(fù)雜,CD8+T細(xì)胞這個群體內(nèi)部其實也存在分工:有的確實是效應(yīng)細(xì)胞毒性T細(xì)胞(Cytotoxic T cell, CTL),但有的卻表現(xiàn)出類似CD4+輔助性T細(xì)胞(Helper T cell)的功能,甚至還有一類具備“先天記憶”(Innate memory, IM)特性,能夠更快速地響應(yīng)威脅。長期以來,一個核心的謎團困擾著免疫學(xué)家:這些功能迥異的CD8+T細(xì)胞亞群是如何在胸腺這個“訓(xùn)練營”中被塑造出來的?是什么決定了它們不同的命運?
傳統(tǒng)的觀點認(rèn)為,T細(xì)胞的譜系命運(是成為輔助性還是細(xì)胞毒性T細(xì)胞)主要取決于其T細(xì)胞受體(T cell receptor, TCR)識別的是主要組織相容性復(fù)合體II類(MHC-II)還是I類(MHC-I)分子。然而,近年來的“動力學(xué)信號模型”提出了更精細(xì)的調(diào)控機制:命運并非由共受體(CD4或CD8)本身決定,而是由TCR信號在陽性選擇過程中的“持續(xù)性”決定的。持續(xù)的信號會誘導(dǎo)輔助性T細(xì)胞的關(guān)鍵轉(zhuǎn)錄因子ThPOK,推動細(xì)胞向輔助性譜系分化;而中斷的信號則會允許細(xì)胞因子誘導(dǎo)細(xì)胞毒性T細(xì)胞的關(guān)鍵轉(zhuǎn)錄因子Runx3d表達(dá),推動向細(xì)胞毒性譜系分化。但是,是什么控制了TCR信號的這種“持續(xù)性”或“中斷”呢?特別是對于所有都被MHC-I分子選擇的CD8+T細(xì)胞來說,其內(nèi)部的功能差異又是如何產(chǎn)生的?這背后是否與它們所識別的具體“身份證”——即由MHC-I分子呈遞的特定胸腺肽有關(guān)?

圖1 解析CD8譜系命運決定:揭示功能各異的CD8+ T細(xì)胞由不同MHC-I胸腺肽選擇形成
為了深入探究MHC-I限制性CD8+T細(xì)胞的譜系命運決定機制,由Miho Shinzawa和Alfred Singer等人組成的研究團隊在《Nature Immunology》上發(fā)表了他們的最新研究。他們設(shè)計了一個巧妙的遺傳學(xué)模型——CD8Dual小鼠。這種小鼠的Cd4和Cd8基因座都編碼CD8共受體蛋白,但分別產(chǎn)生略有差異的CD8.1(由Cd4基因座編碼)和CD8.2(由Cd8基因座編碼)共受體。這一設(shè)計使得研究人員能夠剝離共受體蛋白本身的功能,而專注于研究編碼這些共受體的基因座(Cd4 或 Cd8)對TCR信號動力學(xué)和細(xì)胞命運的固有影響。
研究人員主要運用了基因工程小鼠模型構(gòu)建、流式細(xì)胞術(shù)(Flow Cytometry)進(jìn)行免疫表型分析、體外T細(xì)胞功能刺激實驗、RNA測序(RNA-seq)進(jìn)行轉(zhuǎn)錄組分析、實時定量PCR(RT-qPCR)、以及通過 Rag-GFP 報告基因追蹤胸腺細(xì)胞發(fā)育時序等關(guān)鍵技術(shù)方法。
CD8Dual小鼠揭示Cd4與Cd8基因座導(dǎo)向不同的CD8+T細(xì)胞功能譜系
在CD8Dual小鼠胸腺和外周淋巴器官中,表達(dá)CD8.1共受體的T細(xì)胞和表達(dá)CD8.2共受體的T細(xì)胞均是由MHC-I分子選擇產(chǎn)生的。然而,它們卻走上了截然不同的道路。CD8.1 T細(xì)胞高表達(dá)輔助性T細(xì)胞的關(guān)鍵轉(zhuǎn)錄因子ThPOK,其轉(zhuǎn)錄譜和分子表達(dá)模式與野生型小鼠的CD4+輔助性T細(xì)胞相似。功能上,在體外刺激后,它們能上調(diào)輔助性分子CD40L,并能在TH2極化條件下產(chǎn)生IL-4。更重要的是,在CD8Dual小鼠胸腺內(nèi),也存在由CD8.1 T細(xì)胞分化而來的調(diào)節(jié)性T細(xì)胞(Treg)和恒定自然殺傷T細(xì)胞(iNKT)各亞群(NKT1, NKT2, NKT17)。相反,CD8.2 T細(xì)胞則高表達(dá)細(xì)胞毒性T細(xì)胞的關(guān)鍵轉(zhuǎn)錄因子Runx3d,其特性與野生型小鼠的CD8+細(xì)胞毒性T細(xì)胞類似,在刺激后能產(chǎn)生IFN-γ和顆粒酶B(Granzyme B),并且在淋巴耗竭環(huán)境下具有更強的增殖能力。這些結(jié)果清晰地表明,即使表達(dá)的均是CD8共受體,由Cd4基因座編碼的共受體傾向于推動T細(xì)胞向輔助性譜系分化,而由Cd8基因座編碼的共受體則傾向于推動向細(xì)胞毒性譜系分化。
共受體動力學(xué)與陽性選擇中的TCR信號持續(xù)時間
那么,Cd4和Cd8基因座是如何造成這種差異的呢?答案在于它們對共受體表達(dá)動力學(xué)的調(diào)控不同,進(jìn)而影響了TCR信號的持續(xù)時間。研究人員通過分析胸腺細(xì)胞陽性選擇不同階段(通過CD69和CCR7表達(dá)劃分)的共受體表達(dá)和信號強度指標(biāo)(如CD5),發(fā)現(xiàn)CD8.2(Cd8基因座編碼)的表達(dá)在TCR信號后急性下降,而CD8.1(Cd4基因座編碼)的表達(dá)則穩(wěn)步上升。這與“動力學(xué)信號模型”中Cd8基因表達(dá)會瞬時終止的概念一致。重要的是,依賴于Cd4編碼的CD8.1共受體的MHC-I TCR信號是持續(xù)性的,這誘導(dǎo)了ThPOK的表達(dá);而依賴于Cd8編碼的CD8.2共受體的TCR信號則發(fā)生了中斷,從而允許Runx3d的表達(dá)。成熟T細(xì)胞上CD5和Nur77(TCR信號強度指標(biāo))的表達(dá)水平差異也印證了這一點,CD8.1 T細(xì)胞始終表現(xiàn)出更強的信號痕跡。
不同MHC-I胸腺選擇肽選擇功能不同的CD8+T細(xì)胞
接下來,研究團隊探索了更根本的問題:是什么初始因素決定了TCR信號的持續(xù)性或中斷?他們將目光投向了TCR識別的對象——胸腺肽。胸腺肽主要由胸腺皮質(zhì)上皮細(xì)胞(cTEC)加工產(chǎn)生。其中,cTEC特有的胸腺蛋白酶體(含有β5t亞基)產(chǎn)生β5t肽,而其他蛋白酶體則產(chǎn)生非β5t肽。關(guān)鍵區(qū)別在于,β5t肽僅存在于cTEC,而非β5t肽在胸腺內(nèi)廣泛表達(dá)(包括cTEC和皮質(zhì)髓質(zhì)交界處/髓質(zhì)細(xì)胞)。
通過比較β5t基因野生型(β5tWT)和敲除型(β5tKO)的CD8Dual小鼠,研究人員有了驚人發(fā)現(xiàn):CD8.1輔助性T細(xì)胞的產(chǎn)生完全不受β5t缺失的影響,說明它們完全由非β5t肽選擇。而CD8.2細(xì)胞毒性T細(xì)胞的產(chǎn)生則部分依賴于β5t肽(在β5tKO小鼠中減少約50%),表明它們可由β5t肽和非β5t肽共同選擇。進(jìn)一步分析發(fā)現(xiàn),由β5t肽選擇的CD8.2 T細(xì)胞是常規(guī)的細(xì)胞毒性T細(xì)胞(CV, Runx3+Eomes-),而在β5tKO小鼠中殘存的、由非β5t肽選擇的CD8.2 T細(xì)胞則幾乎全是先天記憶樣T細(xì)胞(IM, Runx3+Eomes+)。IM細(xì)胞的生成依賴于IL-4,并在PLZFKO或CD1dKO(缺乏iNKT細(xì)胞)小鼠中被廢除。通過Rag-GFP報告基因分析發(fā)育時序,發(fā)現(xiàn)IM CD8+T細(xì)胞的出現(xiàn)比CV細(xì)胞晚約10小時,且CD5表達(dá)更高,提示其接受了由非β5t肽在胸腺皮質(zhì)外區(qū)域(如髓質(zhì))引發(fā)的“晚期TCR信號”。這種晚期信號可能延遲了胸腺細(xì)胞的遷出,使其有更多時間暴露于由NKT2細(xì)胞產(chǎn)生的IL-4中,從而促進(jìn)IM表型的獲得。
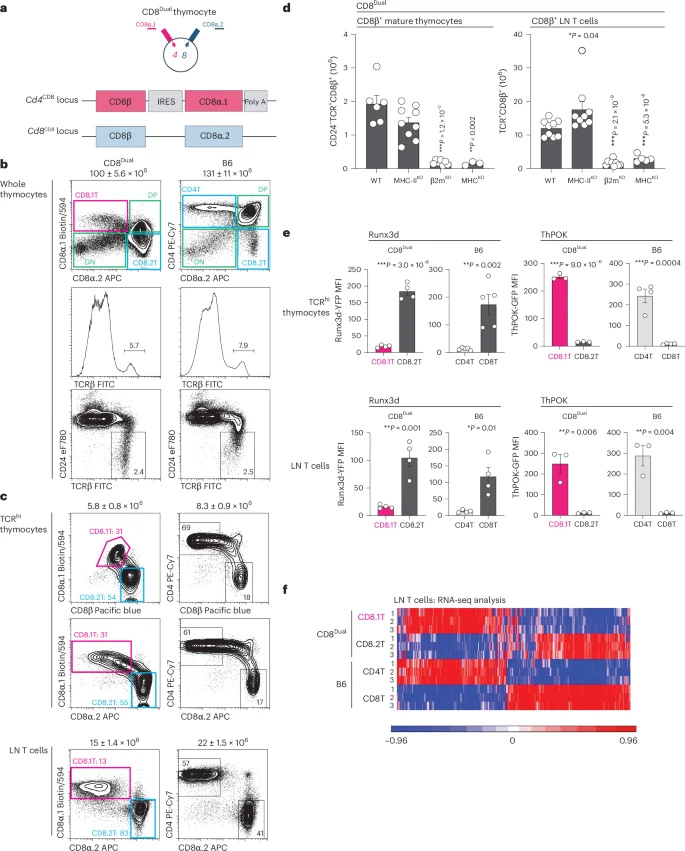
圖2 CD8Dual小鼠的表征
機制在野生型小鼠中的普適性
為了驗證這一機制并非CD8Dual小鼠特有,研究團隊在野生型BALB/c和C57BL/6(B6)小鼠中進(jìn)行了驗證。在富含IL-4和NKT2細(xì)胞的BALB/c小鼠中,β5t的缺失同樣幾乎完全廢除了CV CD8+T細(xì)胞的生成,但不影響IM CD8+T細(xì)胞。而在缺乏IL-4、IM CD8+T細(xì)胞本就極少的B6小鼠中,β5t缺失也主要影響CV細(xì)胞的生成。這表明,不同胸腺肽選擇不同功能CD8+T細(xì)胞的機制是普遍存在的,而不同品系小鼠胸腺內(nèi)細(xì)胞因子環(huán)境(如IL-4水平)的差異決定了IM細(xì)胞群體的規(guī)模。
研究結(jié)論與意義
本研究得出了顛覆性的結(jié)論:CD8+T細(xì)胞的功能命運并非預(yù)先注定,而是在胸腺陽性選擇過程中,由特定MHC-I胸腺選擇肽通過調(diào)控TCR信號持續(xù)時間來精確決定的。β5t肽由于其局限于胸腺皮特的分布,其介導(dǎo)的TCR信號在胸腺細(xì)胞離開皮質(zhì)時必然中斷,從而專一性地產(chǎn)生細(xì)胞毒性CD8+T細(xì)胞。而非β5t肽因其在胸腺內(nèi)廣泛分布,使得TCR信號有可能持續(xù)(誘導(dǎo)輔助性命運)或在皮質(zhì)外重現(xiàn)(“晚期信號”,與IL-4協(xié)同誘導(dǎo)先天記憶命運)。因此,是肽在胸腺內(nèi)的“空間分布”特性,而非其絕對的序列特征,最終決定了其所選擇的CD8+T細(xì)胞的功能屬性。
這項研究成功地整合了T細(xì)胞識別的肽特異性、T細(xì)胞的功能獲得以及胸腺細(xì)胞的遷移過程這三個關(guān)鍵維度,為理解胸腺中CD8+T細(xì)胞功能異質(zhì)性的起源提供了全新的框架。它不僅深化了對T細(xì)胞發(fā)育生物學(xué)的認(rèn)識,也對未來旨在定向調(diào)控T細(xì)胞功能(例如,在腫瘤免疫治療或自身免疫病干預(yù)中)的策略提供了重要的理論基礎(chǔ)。
參考資料
[1] Unraveling CD8 lineage decisions reveals that functionally distinct CD8+ T cells are selected by different MHC-I thymic peptides
摘要:研究針對胸腺中MHC-I限制性CD8+T細(xì)胞如何獲得不同功能(輔助、細(xì)胞毒、先天記憶)這一核心問題展開。
在我們身體的免疫司令部——胸腺中,未成熟的T細(xì)胞前體經(jīng)歷一場嚴(yán)格的“選拔”才能成為合格的免疫戰(zhàn)士。其中,CD8+T細(xì)胞通常被認(rèn)為是專職的“殺手”細(xì)胞,負(fù)責(zé)清除被病毒感染或癌變的細(xì)胞。然而,免疫系統(tǒng)遠(yuǎn)比我們想象的復(fù)雜,CD8+T細(xì)胞這個群體內(nèi)部其實也存在分工:有的確實是效應(yīng)細(xì)胞毒性T細(xì)胞(Cytotoxic T cell, CTL),但有的卻表現(xiàn)出類似CD4+輔助性T細(xì)胞(Helper T cell)的功能,甚至還有一類具備“先天記憶”(Innate memory, IM)特性,能夠更快速地響應(yīng)威脅。長期以來,一個核心的謎團困擾著免疫學(xué)家:這些功能迥異的CD8+T細(xì)胞亞群是如何在胸腺這個“訓(xùn)練營”中被塑造出來的?是什么決定了它們不同的命運?
傳統(tǒng)的觀點認(rèn)為,T細(xì)胞的譜系命運(是成為輔助性還是細(xì)胞毒性T細(xì)胞)主要取決于其T細(xì)胞受體(T cell receptor, TCR)識別的是主要組織相容性復(fù)合體II類(MHC-II)還是I類(MHC-I)分子。然而,近年來的“動力學(xué)信號模型”提出了更精細(xì)的調(diào)控機制:命運并非由共受體(CD4或CD8)本身決定,而是由TCR信號在陽性選擇過程中的“持續(xù)性”決定的。持續(xù)的信號會誘導(dǎo)輔助性T細(xì)胞的關(guān)鍵轉(zhuǎn)錄因子ThPOK,推動細(xì)胞向輔助性譜系分化;而中斷的信號則會允許細(xì)胞因子誘導(dǎo)細(xì)胞毒性T細(xì)胞的關(guān)鍵轉(zhuǎn)錄因子Runx3d表達(dá),推動向細(xì)胞毒性譜系分化。但是,是什么控制了TCR信號的這種“持續(xù)性”或“中斷”呢?特別是對于所有都被MHC-I分子選擇的CD8+T細(xì)胞來說,其內(nèi)部的功能差異又是如何產(chǎn)生的?這背后是否與它們所識別的具體“身份證”——即由MHC-I分子呈遞的特定胸腺肽有關(guān)?

圖1 解析CD8譜系命運決定:揭示功能各異的CD8+ T細(xì)胞由不同MHC-I胸腺肽選擇形成
為了深入探究MHC-I限制性CD8+T細(xì)胞的譜系命運決定機制,由Miho Shinzawa和Alfred Singer等人組成的研究團隊在《Nature Immunology》上發(fā)表了他們的最新研究。他們設(shè)計了一個巧妙的遺傳學(xué)模型——CD8Dual小鼠。這種小鼠的Cd4和Cd8基因座都編碼CD8共受體蛋白,但分別產(chǎn)生略有差異的CD8.1(由Cd4基因座編碼)和CD8.2(由Cd8基因座編碼)共受體。這一設(shè)計使得研究人員能夠剝離共受體蛋白本身的功能,而專注于研究編碼這些共受體的基因座(Cd4 或 Cd8)對TCR信號動力學(xué)和細(xì)胞命運的固有影響。
研究人員主要運用了基因工程小鼠模型構(gòu)建、流式細(xì)胞術(shù)(Flow Cytometry)進(jìn)行免疫表型分析、體外T細(xì)胞功能刺激實驗、RNA測序(RNA-seq)進(jìn)行轉(zhuǎn)錄組分析、實時定量PCR(RT-qPCR)、以及通過 Rag-GFP 報告基因追蹤胸腺細(xì)胞發(fā)育時序等關(guān)鍵技術(shù)方法。
CD8Dual小鼠揭示Cd4與Cd8基因座導(dǎo)向不同的CD8+T細(xì)胞功能譜系
在CD8Dual小鼠胸腺和外周淋巴器官中,表達(dá)CD8.1共受體的T細(xì)胞和表達(dá)CD8.2共受體的T細(xì)胞均是由MHC-I分子選擇產(chǎn)生的。然而,它們卻走上了截然不同的道路。CD8.1 T細(xì)胞高表達(dá)輔助性T細(xì)胞的關(guān)鍵轉(zhuǎn)錄因子ThPOK,其轉(zhuǎn)錄譜和分子表達(dá)模式與野生型小鼠的CD4+輔助性T細(xì)胞相似。功能上,在體外刺激后,它們能上調(diào)輔助性分子CD40L,并能在TH2極化條件下產(chǎn)生IL-4。更重要的是,在CD8Dual小鼠胸腺內(nèi),也存在由CD8.1 T細(xì)胞分化而來的調(diào)節(jié)性T細(xì)胞(Treg)和恒定自然殺傷T細(xì)胞(iNKT)各亞群(NKT1, NKT2, NKT17)。相反,CD8.2 T細(xì)胞則高表達(dá)細(xì)胞毒性T細(xì)胞的關(guān)鍵轉(zhuǎn)錄因子Runx3d,其特性與野生型小鼠的CD8+細(xì)胞毒性T細(xì)胞類似,在刺激后能產(chǎn)生IFN-γ和顆粒酶B(Granzyme B),并且在淋巴耗竭環(huán)境下具有更強的增殖能力。這些結(jié)果清晰地表明,即使表達(dá)的均是CD8共受體,由Cd4基因座編碼的共受體傾向于推動T細(xì)胞向輔助性譜系分化,而由Cd8基因座編碼的共受體則傾向于推動向細(xì)胞毒性譜系分化。
共受體動力學(xué)與陽性選擇中的TCR信號持續(xù)時間
那么,Cd4和Cd8基因座是如何造成這種差異的呢?答案在于它們對共受體表達(dá)動力學(xué)的調(diào)控不同,進(jìn)而影響了TCR信號的持續(xù)時間。研究人員通過分析胸腺細(xì)胞陽性選擇不同階段(通過CD69和CCR7表達(dá)劃分)的共受體表達(dá)和信號強度指標(biāo)(如CD5),發(fā)現(xiàn)CD8.2(Cd8基因座編碼)的表達(dá)在TCR信號后急性下降,而CD8.1(Cd4基因座編碼)的表達(dá)則穩(wěn)步上升。這與“動力學(xué)信號模型”中Cd8基因表達(dá)會瞬時終止的概念一致。重要的是,依賴于Cd4編碼的CD8.1共受體的MHC-I TCR信號是持續(xù)性的,這誘導(dǎo)了ThPOK的表達(dá);而依賴于Cd8編碼的CD8.2共受體的TCR信號則發(fā)生了中斷,從而允許Runx3d的表達(dá)。成熟T細(xì)胞上CD5和Nur77(TCR信號強度指標(biāo))的表達(dá)水平差異也印證了這一點,CD8.1 T細(xì)胞始終表現(xiàn)出更強的信號痕跡。
不同MHC-I胸腺選擇肽選擇功能不同的CD8+T細(xì)胞
接下來,研究團隊探索了更根本的問題:是什么初始因素決定了TCR信號的持續(xù)性或中斷?他們將目光投向了TCR識別的對象——胸腺肽。胸腺肽主要由胸腺皮質(zhì)上皮細(xì)胞(cTEC)加工產(chǎn)生。其中,cTEC特有的胸腺蛋白酶體(含有β5t亞基)產(chǎn)生β5t肽,而其他蛋白酶體則產(chǎn)生非β5t肽。關(guān)鍵區(qū)別在于,β5t肽僅存在于cTEC,而非β5t肽在胸腺內(nèi)廣泛表達(dá)(包括cTEC和皮質(zhì)髓質(zhì)交界處/髓質(zhì)細(xì)胞)。
通過比較β5t基因野生型(β5tWT)和敲除型(β5tKO)的CD8Dual小鼠,研究人員有了驚人發(fā)現(xiàn):CD8.1輔助性T細(xì)胞的產(chǎn)生完全不受β5t缺失的影響,說明它們完全由非β5t肽選擇。而CD8.2細(xì)胞毒性T細(xì)胞的產(chǎn)生則部分依賴于β5t肽(在β5tKO小鼠中減少約50%),表明它們可由β5t肽和非β5t肽共同選擇。進(jìn)一步分析發(fā)現(xiàn),由β5t肽選擇的CD8.2 T細(xì)胞是常規(guī)的細(xì)胞毒性T細(xì)胞(CV, Runx3+Eomes-),而在β5tKO小鼠中殘存的、由非β5t肽選擇的CD8.2 T細(xì)胞則幾乎全是先天記憶樣T細(xì)胞(IM, Runx3+Eomes+)。IM細(xì)胞的生成依賴于IL-4,并在PLZFKO或CD1dKO(缺乏iNKT細(xì)胞)小鼠中被廢除。通過Rag-GFP報告基因分析發(fā)育時序,發(fā)現(xiàn)IM CD8+T細(xì)胞的出現(xiàn)比CV細(xì)胞晚約10小時,且CD5表達(dá)更高,提示其接受了由非β5t肽在胸腺皮質(zhì)外區(qū)域(如髓質(zhì))引發(fā)的“晚期TCR信號”。這種晚期信號可能延遲了胸腺細(xì)胞的遷出,使其有更多時間暴露于由NKT2細(xì)胞產(chǎn)生的IL-4中,從而促進(jìn)IM表型的獲得。

圖2 CD8Dual小鼠的表征
機制在野生型小鼠中的普適性
為了驗證這一機制并非CD8Dual小鼠特有,研究團隊在野生型BALB/c和C57BL/6(B6)小鼠中進(jìn)行了驗證。在富含IL-4和NKT2細(xì)胞的BALB/c小鼠中,β5t的缺失同樣幾乎完全廢除了CV CD8+T細(xì)胞的生成,但不影響IM CD8+T細(xì)胞。而在缺乏IL-4、IM CD8+T細(xì)胞本就極少的B6小鼠中,β5t缺失也主要影響CV細(xì)胞的生成。這表明,不同胸腺肽選擇不同功能CD8+T細(xì)胞的機制是普遍存在的,而不同品系小鼠胸腺內(nèi)細(xì)胞因子環(huán)境(如IL-4水平)的差異決定了IM細(xì)胞群體的規(guī)模。
研究結(jié)論與意義
本研究得出了顛覆性的結(jié)論:CD8+T細(xì)胞的功能命運并非預(yù)先注定,而是在胸腺陽性選擇過程中,由特定MHC-I胸腺選擇肽通過調(diào)控TCR信號持續(xù)時間來精確決定的。β5t肽由于其局限于胸腺皮特的分布,其介導(dǎo)的TCR信號在胸腺細(xì)胞離開皮質(zhì)時必然中斷,從而專一性地產(chǎn)生細(xì)胞毒性CD8+T細(xì)胞。而非β5t肽因其在胸腺內(nèi)廣泛分布,使得TCR信號有可能持續(xù)(誘導(dǎo)輔助性命運)或在皮質(zhì)外重現(xiàn)(“晚期信號”,與IL-4協(xié)同誘導(dǎo)先天記憶命運)。因此,是肽在胸腺內(nèi)的“空間分布”特性,而非其絕對的序列特征,最終決定了其所選擇的CD8+T細(xì)胞的功能屬性。
這項研究成功地整合了T細(xì)胞識別的肽特異性、T細(xì)胞的功能獲得以及胸腺細(xì)胞的遷移過程這三個關(guān)鍵維度,為理解胸腺中CD8+T細(xì)胞功能異質(zhì)性的起源提供了全新的框架。它不僅深化了對T細(xì)胞發(fā)育生物學(xué)的認(rèn)識,也對未來旨在定向調(diào)控T細(xì)胞功能(例如,在腫瘤免疫治療或自身免疫病干預(yù)中)的策略提供了重要的理論基礎(chǔ)。
參考資料
[1] Unraveling CD8 lineage decisions reveals that functionally distinct CD8+ T cells are selected by different MHC-I thymic peptides



