摘要:研究針對缺乏標準系統(tǒng)療法的纖維板層型肝癌(FLC),開發(fā)了靶向DNAJB1::PRKACA融合蛋白(DNAJ-PKAc)的治療性肽疫苗FLC-Vac,聯(lián)合nivolumab和ipilimumab用于晚期FLC患者。
在兒童和年輕成人中罕見的纖維板層型肝癌(FLC),是一種侵襲性強且缺乏有效系統(tǒng)療法的肝臟惡性腫瘤。對于無法手術(shù)的患者,中位生存期僅約12個月。這種癌癥的分子特征是一個獨特的基因融合事件——DNAJB1與PRKACA基因的融合,產(chǎn)生一種嵌合蛋白DNAJ-PKAc。雖然分子靶向治療已在許多融合驅(qū)動型癌癥中取得突破,但針對DNAJ-PKAc的抑制劑開發(fā)卻因難以接受的靶向毒性而受阻。
面對這一挑戰(zhàn),研究人員將目光轉(zhuǎn)向免疫治療領(lǐng)域。DNAJ-PKAc融合蛋白作為一種腫瘤特異性抗原(新抗原),為免疫靶向提供了理想標靶。更重要的是,該融合斷點位于內(nèi)含子區(qū)域,使得嵌合蛋白序列在患者間高度一致,這意味著單一疫苗即可適用于所有FLC患者,無需個性化定制。

圖1 針對纖維板層型肝細胞癌的治療性肽疫苗:I期臨床試驗
在這項發(fā)表于《Nature Medicine》的突破性研究中,研究人員開展了一項Ⅰ期臨床試驗,評估了一種靶向DNAJ-PKAc的治療性肽疫苗(FLC-Vac)聯(lián)合nivolumab和ipilimumab,在未接受過免疫檢查點治療的晚期FLC患者中的安全性和有效性。研究的主要終點是安全性和第10周時的T細胞應(yīng)答。
研究團隊采用了多項前沿技術(shù)方法:通過ELISpot(酶聯(lián)免疫斑點檢測)評估抗原特異性T細胞反應(yīng);利用TIRTL-seq(一種高通量配對TCR測序技術(shù))分析T細胞受體 repertoire(受體庫)動態(tài)變化;運用CyTOF(質(zhì)譜流式細胞術(shù))進行高維免疫表型分析;結(jié)合單細胞RNA測序和流式細胞術(shù)鑒定功能性T細胞克??;并通過RNAscope(原位RNA雜交技術(shù))和免疫組化驗證靶抗原和HLA(人類白細胞抗原)表達。研究納入了16例不可切除FLC患者(中位年齡24歲),其中12例完成了疫苗初始接種階段并可評估免疫學和臨床終點。
臨床療效顯著
在完成初始接種階段的12例患者中,客觀緩解率(ORR)達到25%,疾病控制率(DCR)為75%。中位無進展生存期(PFS)為8.5個月,中位總生存期(OS)尚未達到。所有3例應(yīng)答者的腫瘤均為錯配修復(fù)正常、腫瘤突變負荷低(<10個突變/兆堿基)且PD-L1表達陰性(<1%),表明疫苗在傳統(tǒng)免疫治療不敏感的患者群體中仍能激發(fā)有效抗腫瘤免疫。< div="">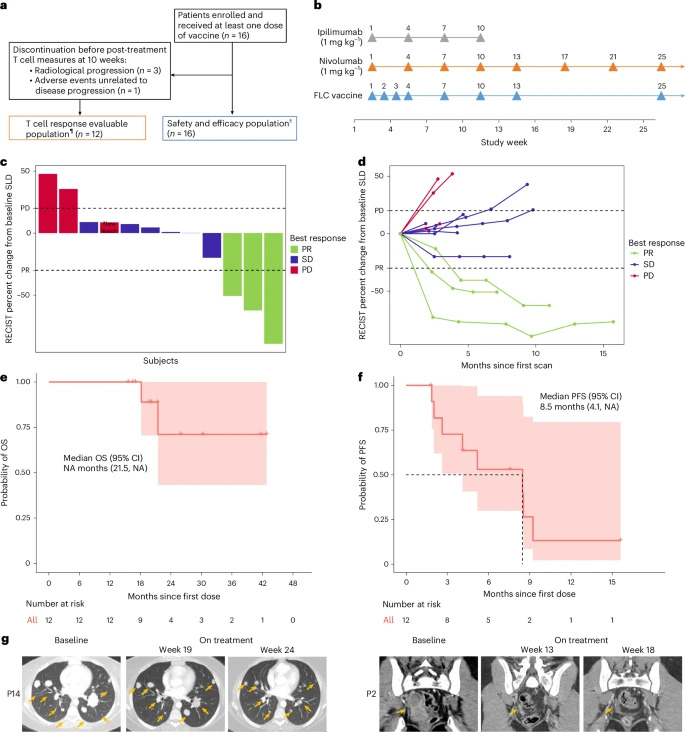
圖2 FLC疫苗聯(lián)合伊匹木單抗與納武利尤單抗治療FLC患者的臨床療效
安全性可控
安全性分析顯示,最常見的疫苗相關(guān)不良事件為注射部位反應(yīng)(100%)、頭痛(50%)和疲勞(45%),均為1-2級。6例患者(37.5%)報告了3級治療相關(guān)不良事件,類型與ipilimumab聯(lián)合nivolumab的已知安全性特征一致,未觀察到4級或5級事件。
DNAJ-PKAc特異性T細胞應(yīng)答是臨床活性的前提
免疫應(yīng)答分析顯示,治療后75%(9/12)的患者外周血中檢測到針對全長疫苗肽的T細胞應(yīng)答,且所有臨床應(yīng)答者均產(chǎn)生了DNAJ-PKAc特異性T細胞應(yīng)答。研究人員從應(yīng)答者中鑒定出多個HLA-II類限制性的T細胞受體(TCR),這些TCR識別融合蛋白的不同重疊15肽表位,表明疫苗成功激發(fā)了多克隆CD4+ T輔助細胞應(yīng)答。
TCR repertoire動態(tài)變化與臨床應(yīng)答相關(guān)
通過TIRTL-seq技術(shù),研究人員深入分析了患者外周血TCR repertoire的縱向變化。發(fā)現(xiàn)接受疫苗聯(lián)合免疫檢查點抑制劑(ICI)治療的患者,相比單用疫苗的患者,在治療早期表現(xiàn)出更顯著的TCR克隆擴增。應(yīng)答者的特征是與非應(yīng)答者相比,其擴增的TCR克隆表現(xiàn)出更強的序列相似性聚類,且TCR網(wǎng)絡(luò)連通性隨時間增加。
DNAJ-PKAc特異性T細胞應(yīng)答的特征
對一名顯著應(yīng)答者(P12)的深入分析顯示,治療后其外周血中出現(xiàn)了多種DNAJ-PKAc特異性TCR,這些TCR均通過HLA-DR等位基因識別新抗原,且主要位于表達CD40LG、IFN-γ和TNF等激活標志的CD4+ T細胞簇中。值得注意的是,研究人員發(fā)現(xiàn)了跨患者共享的"公共"TCR克隆,特別是在表達HLA-DRB3 * 01:01的患者中,這種共享特征在腫瘤抗原應(yīng)答中極為罕見。
獲得性耐藥由T細胞耗竭驅(qū)動
與傳統(tǒng)免疫治療耐藥機制不同,研究人員在耐藥患者中未發(fā)現(xiàn)DNAJ-PKAc丟失或HLA表達缺失。相反,耐藥病灶表現(xiàn)出T細胞被限制在腫瘤外圍,并高表達TIM3和LAG3等耗竭標志。腫瘤微環(huán)境分析顯示粒細胞增加、B細胞浸潤減少以及髓系細胞重編程,表明T細胞 trafficking(遷移)受損和耗竭是主要耐藥機制。這一發(fā)現(xiàn)的重要臨床意義在于,一名患者在疾病進展后重新挑戰(zhàn)ipilimumab聯(lián)合nivolumab治療,獲得了完全緩解,證明針對T細胞耗竭的策略可克服耐藥。

圖2 FLC疫苗聯(lián)合伊匹木單抗與納武利尤單抗治療FLC患者的臨床療效
研究結(jié)論與意義
本研究首次證實了靶向"不可成藥"致癌驅(qū)動因子的現(xiàn)貨型(therapeutical peptide vaccine)治療性肽疫苗在實體瘤中的臨床可行性。FLC-Vac聯(lián)合免疫檢查點抑制劑在晚期FLC患者中展示了良好的安全性和令人鼓舞的療效,特別是能夠激發(fā)針對共享新抗原的CD4+ T細胞主導的免疫應(yīng)答。
該研究的創(chuàng)新點在于:首先,提出了結(jié)合TCR repertoire相似性度量和功能性免疫應(yīng)答的綜合分層策略,可更好預(yù)測治療反應(yīng);其次,發(fā)現(xiàn)了跨患者共享的"公共"TCR特征,為開發(fā)通用型T細胞療法提供了新靶點;最后,明確了T細胞耗竭而非抗原丟失是主要耐藥機制,為聯(lián)合治療策略指明了方向。
這項研究不僅為FLC這一罕見病提供了新的治療希望,更重要的是為靶向共享新抗原的癌癥疫苗開發(fā)建立了范式。對于腫瘤突變負荷低、傳統(tǒng)免疫治療不敏感的癌癥類型,靶向致癌驅(qū)動因子衍生的新抗原代表了一種極具前景的治療策略。由于這些新抗原對腫瘤細胞的生存優(yōu)勢至關(guān)重要,其在疾病進展過程中持續(xù)表達,避免了免疫編輯導致的抗原丟失,從而為實現(xiàn)長期疾病控制提供了可能。
該研究的成功證實了免疫系統(tǒng)能夠有效靶向之前認為"不可成藥"的致癌蛋白,為擴大癌癥免疫治療適用人群開辟了新途徑。隨著更多共享新抗原的發(fā)現(xiàn)和疫苗技術(shù)的優(yōu)化,這種策略有望應(yīng)用于更多缺乏有效治療選擇的癌癥類型。
參考資料
[1] A therapeutic peptide vaccine for fibrolamellar hepatocellular carcinoma: a phase 1 trial
摘要:研究針對缺乏標準系統(tǒng)療法的纖維板層型肝癌(FLC),開發(fā)了靶向DNAJB1::PRKACA融合蛋白(DNAJ-PKAc)的治療性肽疫苗FLC-Vac,聯(lián)合nivolumab和ipilimumab用于晚期FLC患者。
在兒童和年輕成人中罕見的纖維板層型肝癌(FLC),是一種侵襲性強且缺乏有效系統(tǒng)療法的肝臟惡性腫瘤。對于無法手術(shù)的患者,中位生存期僅約12個月。這種癌癥的分子特征是一個獨特的基因融合事件——DNAJB1與PRKACA基因的融合,產(chǎn)生一種嵌合蛋白DNAJ-PKAc。雖然分子靶向治療已在許多融合驅(qū)動型癌癥中取得突破,但針對DNAJ-PKAc的抑制劑開發(fā)卻因難以接受的靶向毒性而受阻。
面對這一挑戰(zhàn),研究人員將目光轉(zhuǎn)向免疫治療領(lǐng)域。DNAJ-PKAc融合蛋白作為一種腫瘤特異性抗原(新抗原),為免疫靶向提供了理想標靶。更重要的是,該融合斷點位于內(nèi)含子區(qū)域,使得嵌合蛋白序列在患者間高度一致,這意味著單一疫苗即可適用于所有FLC患者,無需個性化定制。

圖1 針對纖維板層型肝細胞癌的治療性肽疫苗:I期臨床試驗
在這項發(fā)表于《Nature Medicine》的突破性研究中,研究人員開展了一項Ⅰ期臨床試驗,評估了一種靶向DNAJ-PKAc的治療性肽疫苗(FLC-Vac)聯(lián)合nivolumab和ipilimumab,在未接受過免疫檢查點治療的晚期FLC患者中的安全性和有效性。研究的主要終點是安全性和第10周時的T細胞應(yīng)答。
研究團隊采用了多項前沿技術(shù)方法:通過ELISpot(酶聯(lián)免疫斑點檢測)評估抗原特異性T細胞反應(yīng);利用TIRTL-seq(一種高通量配對TCR測序技術(shù))分析T細胞受體 repertoire(受體庫)動態(tài)變化;運用CyTOF(質(zhì)譜流式細胞術(shù))進行高維免疫表型分析;結(jié)合單細胞RNA測序和流式細胞術(shù)鑒定功能性T細胞克??;并通過RNAscope(原位RNA雜交技術(shù))和免疫組化驗證靶抗原和HLA(人類白細胞抗原)表達。研究納入了16例不可切除FLC患者(中位年齡24歲),其中12例完成了疫苗初始接種階段并可評估免疫學和臨床終點。
臨床療效顯著
在完成初始接種階段的12例患者中,客觀緩解率(ORR)達到25%,疾病控制率(DCR)為75%。中位無進展生存期(PFS)為8.5個月,中位總生存期(OS)尚未達到。所有3例應(yīng)答者的腫瘤均為錯配修復(fù)正常、腫瘤突變負荷低(<10個突變/兆堿基)且PD-L1表達陰性(<1%),表明疫苗在傳統(tǒng)免疫治療不敏感的患者群體中仍能激發(fā)有效抗腫瘤免疫。< div="">
圖2 FLC疫苗聯(lián)合伊匹木單抗與納武利尤單抗治療FLC患者的臨床療效
安全性可控
安全性分析顯示,最常見的疫苗相關(guān)不良事件為注射部位反應(yīng)(100%)、頭痛(50%)和疲勞(45%),均為1-2級。6例患者(37.5%)報告了3級治療相關(guān)不良事件,類型與ipilimumab聯(lián)合nivolumab的已知安全性特征一致,未觀察到4級或5級事件。
DNAJ-PKAc特異性T細胞應(yīng)答是臨床活性的前提
免疫應(yīng)答分析顯示,治療后75%(9/12)的患者外周血中檢測到針對全長疫苗肽的T細胞應(yīng)答,且所有臨床應(yīng)答者均產(chǎn)生了DNAJ-PKAc特異性T細胞應(yīng)答。研究人員從應(yīng)答者中鑒定出多個HLA-II類限制性的T細胞受體(TCR),這些TCR識別融合蛋白的不同重疊15肽表位,表明疫苗成功激發(fā)了多克隆CD4+ T輔助細胞應(yīng)答。
TCR repertoire動態(tài)變化與臨床應(yīng)答相關(guān)
通過TIRTL-seq技術(shù),研究人員深入分析了患者外周血TCR repertoire的縱向變化。發(fā)現(xiàn)接受疫苗聯(lián)合免疫檢查點抑制劑(ICI)治療的患者,相比單用疫苗的患者,在治療早期表現(xiàn)出更顯著的TCR克隆擴增。應(yīng)答者的特征是與非應(yīng)答者相比,其擴增的TCR克隆表現(xiàn)出更強的序列相似性聚類,且TCR網(wǎng)絡(luò)連通性隨時間增加。
DNAJ-PKAc特異性T細胞應(yīng)答的特征
對一名顯著應(yīng)答者(P12)的深入分析顯示,治療后其外周血中出現(xiàn)了多種DNAJ-PKAc特異性TCR,這些TCR均通過HLA-DR等位基因識別新抗原,且主要位于表達CD40LG、IFN-γ和TNF等激活標志的CD4+ T細胞簇中。值得注意的是,研究人員發(fā)現(xiàn)了跨患者共享的"公共"TCR克隆,特別是在表達HLA-DRB3 * 01:01的患者中,這種共享特征在腫瘤抗原應(yīng)答中極為罕見。
獲得性耐藥由T細胞耗竭驅(qū)動
與傳統(tǒng)免疫治療耐藥機制不同,研究人員在耐藥患者中未發(fā)現(xiàn)DNAJ-PKAc丟失或HLA表達缺失。相反,耐藥病灶表現(xiàn)出T細胞被限制在腫瘤外圍,并高表達TIM3和LAG3等耗竭標志。腫瘤微環(huán)境分析顯示粒細胞增加、B細胞浸潤減少以及髓系細胞重編程,表明T細胞 trafficking(遷移)受損和耗竭是主要耐藥機制。這一發(fā)現(xiàn)的重要臨床意義在于,一名患者在疾病進展后重新挑戰(zhàn)ipilimumab聯(lián)合nivolumab治療,獲得了完全緩解,證明針對T細胞耗竭的策略可克服耐藥。

圖2 FLC疫苗聯(lián)合伊匹木單抗與納武利尤單抗治療FLC患者的臨床療效
研究結(jié)論與意義
本研究首次證實了靶向"不可成藥"致癌驅(qū)動因子的現(xiàn)貨型(therapeutical peptide vaccine)治療性肽疫苗在實體瘤中的臨床可行性。FLC-Vac聯(lián)合免疫檢查點抑制劑在晚期FLC患者中展示了良好的安全性和令人鼓舞的療效,特別是能夠激發(fā)針對共享新抗原的CD4+ T細胞主導的免疫應(yīng)答。
該研究的創(chuàng)新點在于:首先,提出了結(jié)合TCR repertoire相似性度量和功能性免疫應(yīng)答的綜合分層策略,可更好預(yù)測治療反應(yīng);其次,發(fā)現(xiàn)了跨患者共享的"公共"TCR特征,為開發(fā)通用型T細胞療法提供了新靶點;最后,明確了T細胞耗竭而非抗原丟失是主要耐藥機制,為聯(lián)合治療策略指明了方向。
這項研究不僅為FLC這一罕見病提供了新的治療希望,更重要的是為靶向共享新抗原的癌癥疫苗開發(fā)建立了范式。對于腫瘤突變負荷低、傳統(tǒng)免疫治療不敏感的癌癥類型,靶向致癌驅(qū)動因子衍生的新抗原代表了一種極具前景的治療策略。由于這些新抗原對腫瘤細胞的生存優(yōu)勢至關(guān)重要,其在疾病進展過程中持續(xù)表達,避免了免疫編輯導致的抗原丟失,從而為實現(xiàn)長期疾病控制提供了可能。
該研究的成功證實了免疫系統(tǒng)能夠有效靶向之前認為"不可成藥"的致癌蛋白,為擴大癌癥免疫治療適用人群開辟了新途徑。隨著更多共享新抗原的發(fā)現(xiàn)和疫苗技術(shù)的優(yōu)化,這種策略有望應(yīng)用于更多缺乏有效治療選擇的癌癥類型。
參考資料
[1] A therapeutic peptide vaccine for fibrolamellar hepatocellular carcinoma: a phase 1 trial



