摘要:研究揭示了ATM激酶作為胰島素信號(hào)通路關(guān)鍵介質(zhì)的新功能。
在罕見病研究領(lǐng)域,共濟(jì)失調(diào)毛細(xì)血管擴(kuò)張癥(Ataxia-Telangiectasia, A-T)一直是一個(gè)令人困惑的謎題。這種由ATM基因功能缺失突變引起的常染色體隱性遺傳病,不僅表現(xiàn)為進(jìn)行性小腦共濟(jì)失調(diào)和免疫缺陷,還伴隨著一系列令人費(fèi)解的代謝異?!L(zhǎng)遲緩、肌肉萎縮、意外體重減輕,甚至在老年患者中出現(xiàn)血脂異常、葡萄糖不耐受、非酒精性脂肪肝和糖尿病等代謝合并癥。更令人驚訝的是,臨床研究發(fā)現(xiàn)胰島素抵抗與A-T患者小腦和運(yùn)動(dòng)功能的惡化密切相關(guān),這提示代謝紊亂可能是推動(dòng)神經(jīng)退行性變的關(guān)鍵因素。
長(zhǎng)期以來,ATM激酶主要被認(rèn)為在DNA損傷應(yīng)答中發(fā)揮核心作用,但越來越多的證據(jù)表明它也在代謝調(diào)控中扮演重要角色。胰島素作為調(diào)節(jié)營(yíng)養(yǎng)物質(zhì)吸收和代謝過程的關(guān)鍵激素,其信號(hào)通路與ATM之間存在著令人關(guān)注的交集。先前研究發(fā)現(xiàn)ATM是胰島素信號(hào)的下游介質(zhì),促進(jìn)胰島素刺激的葡萄糖代謝,但許多關(guān)鍵問題仍未解決:胰島素激活A(yù)TM的精確機(jī)制是什么?ATM是否在協(xié)調(diào)胰島素敏感細(xì)胞中分解代謝和合成代謝狀態(tài)之間的動(dòng)態(tài)轉(zhuǎn)換中發(fā)揮作用?為什么這些代謝紊亂主要導(dǎo)致A-T的共濟(jì)失調(diào)癥狀,而不是同樣與小腦損傷相關(guān)的認(rèn)知和精神疾?。?/div>
圖1 α-酮戊二酸緩解共濟(jì)失調(diào)-毛細(xì)血管擴(kuò)張癥小鼠模型的胰島素抵抗與代謝僵化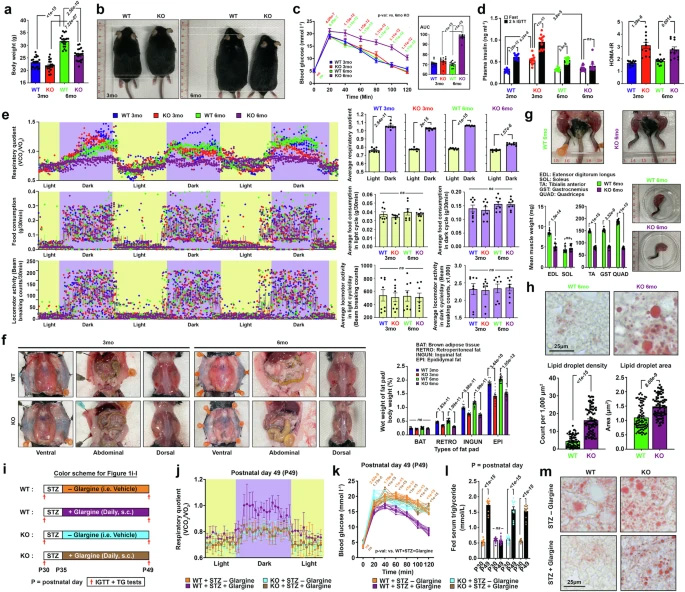
圖2 ATM缺陷引發(fā)高分解代謝表型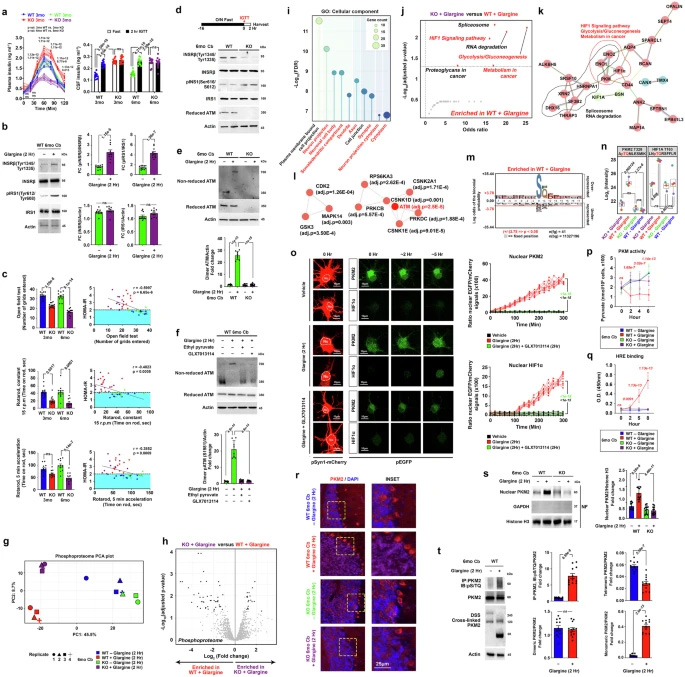
圖3 胰島素激活的ATM調(diào)控小腦中需氧糖酵解的關(guān)鍵調(diào)控因子

圖1 α-酮戊二酸緩解共濟(jì)失調(diào)-毛細(xì)血管擴(kuò)張癥小鼠模型的胰島素抵抗與代謝僵化
發(fā)表在《Nature Communications》的這項(xiàng)研究給出了令人振奮的答案。研究人員發(fā)現(xiàn)ATM缺失會(huì)導(dǎo)致全身性胰島素抵抗和代謝靈活性喪失,引發(fā)代償性的谷氨酰胺依賴性代謝重組。特別重要的是,他們發(fā)現(xiàn)胰島素敏感的小腦Purkinje細(xì)胞——尤其是那些表達(dá)Zebrin-II/ALDOC、在小腦蚓部后葉和絮結(jié)葉中解剖學(xué)豐富的細(xì)胞——對(duì)ATM缺失相關(guān)的代謝變化特別敏感。這種解剖學(xué)特異性易感性導(dǎo)致了A-T共濟(jì)失調(diào)和運(yùn)動(dòng)相關(guān)癥狀的發(fā)展。
研究團(tuán)隊(duì)證明補(bǔ)充α-酮戊二酸(α-ketoglutarate, α-KG)——谷氨酰胺的α-酮酸骨架——能夠減輕谷氨酰胺依賴性,減弱Purkinje細(xì)胞變性。這些發(fā)現(xiàn)表明外周代謝缺陷可能導(dǎo)致A-T中持續(xù)的神經(jīng)退行性變化,強(qiáng)調(diào)了在患者中篩查、監(jiān)測(cè)和解決這些代謝紊亂的重要性。
研究人員運(yùn)用了多種關(guān)鍵技術(shù)方法:使用Atm基因敲除(KO)小鼠模型進(jìn)行體內(nèi)代謝表型分析;通過間接熱量測(cè)定評(píng)估呼吸商(respiratory quotient, RQ)和代謝靈活性;采用穩(wěn)定同位素標(biāo)記的葡萄糖(13C6-U-glucose)和谷氨酰胺(13C5-U-glutamine)進(jìn)行代謝流分析;利用磷酸化蛋白質(zhì)組學(xué)分析胰島素刺激后的信號(hào)網(wǎng)絡(luò);通過免疫組織化學(xué)和免疫印跡評(píng)估蛋白表達(dá)和定位;使用單細(xì)胞RNA測(cè)序數(shù)據(jù)挖掘分析人和小鼠小腦細(xì)胞類型特異性表達(dá)譜。人源樣本來自Coriell醫(yī)學(xué)研究所的A-T患者成纖維細(xì)胞庫(kù)和小腦組織數(shù)據(jù)庫(kù)。
ATM缺失導(dǎo)致系統(tǒng)性胰島素抵抗和代謝不靈活性
研究人員首先在相當(dāng)于人類青春期(3月齡)和成年早期(6月齡)的Atm-KO小鼠中進(jìn)行了全面代謝分析。雖然年輕小鼠的物理參數(shù)沒有明顯差異,但在6月齡Atm-KO中觀察到明顯的生長(zhǎng)遲緩和體重減輕。通過Kraft測(cè)試評(píng)估葡萄糖耐受性(靜脈葡萄糖耐受測(cè)試, IGTT)和胰島素反應(yīng),發(fā)現(xiàn)3月齡小鼠雖然表現(xiàn)出接近正常的葡萄糖耐受性,但血漿胰島素譜升高表明存在前驅(qū)糖尿病胰島素抵抗。相比之下,大多數(shù)6月齡Atm-KO小鼠出現(xiàn)葡萄糖不耐受并伴有胰島素反應(yīng)受損,提示向2型糖尿病進(jìn)展。
間接熱量測(cè)定測(cè)試顯示,6月齡Atm-KO小鼠在光暗周期中都表現(xiàn)出持續(xù)、非波動(dòng)的呼吸商(RQ)值(0.8-0.9之間,表明蛋白質(zhì)分解代謝),而其他實(shí)驗(yàn)組在黑暗周期中表現(xiàn)出從蛋白質(zhì)/脂質(zhì)代謝向碳水化合物分解代謝(RQ=0.9-1)轉(zhuǎn)換的強(qiáng)大能力。這種因胰島素抵抗和糖尿病并發(fā)癥導(dǎo)致的代謝靈活性缺乏,耗盡了脂肪儲(chǔ)備和骨骼肌。

圖2 ATM缺陷引發(fā)高分解代謝表型
小腦Purkinje細(xì)胞對(duì)胰島素敏感且與外周胰島素抵抗功能相關(guān)
研究發(fā)現(xiàn)ATM在小腦皮層中的基因表達(dá)水平在出生前和出生后期間始終高于其他腦區(qū)域。胰島素受體(INSR)也表現(xiàn)出類似的表達(dá)模式。免疫組織化學(xué)分析顯示INSRβ和IRS1信號(hào)在Purkinje細(xì)胞(IP3R1+)中顯著存在,提示它們對(duì)來自外周循環(huán)的胰島素具有響應(yīng)性。
在體內(nèi)環(huán)境下,記錄IGTT引入血糖激增后的胰島素反應(yīng)時(shí)間動(dòng)態(tài)。通常,血漿胰島素水平升高持續(xù)時(shí)間約為2小時(shí),然后恢復(fù)到接近基線水平。在所有Atm-KO小鼠中,在IGTT啟動(dòng)前和啟動(dòng)后2小時(shí)檢測(cè)到腦脊液(CSF)中基礎(chǔ)和飽和胰島素濃度升高,這與其他前驅(qū)糖尿病模型中發(fā)現(xiàn)的現(xiàn)象相似。
功能上,運(yùn)動(dòng)和協(xié)調(diào)功能的行為評(píng)估與相應(yīng)的HOMA-IR指數(shù)顯示出負(fù)相關(guān)。這促使研究人員檢查從6月齡小鼠IGTT后2小時(shí)采集的小腦組織。Atm-KO組顯示胰島素抵抗的跡象,其特征是INSRβ的酪氨酸自磷酸化減少,同時(shí)IRS1的絲氨酸磷酸化增加。
ATM缺陷導(dǎo)致小腦糖酵解不足和向谷氨酰胺依賴轉(zhuǎn)變
全局代謝譜分析顯示,與"蛋氨酸代謝"和"甘氨酸和絲氨酸代謝"相關(guān)的代謝物在ATM缺失的情況下持續(xù)升高,而常見下調(diào)的代謝物主要涉及中央糖酵解網(wǎng)絡(luò)(如Warburg效應(yīng)、糖異生、糖酵解、果糖和甘露糖降解),提示糖酵解活性降低。參與多種脂質(zhì)生物合成途徑的代謝物也減少。
體外小腦培養(yǎng)的線粒體燃料依賴性分析顯示,從葡萄糖到谷氨酰胺作為主要呼吸燃料的顯著轉(zhuǎn)變。進(jìn)一步同位素示蹤分析表明,即使在未刺激條件下,葡萄糖向甘油-3-磷酸(G3P, M+3)和α-酮戊二酸(α-KG)(M+2, M+4來自第二輪TCA)的通量在Atm-KO中已經(jīng)受損。經(jīng)過2小時(shí)的glargine暴露,Atm-WT組迅速將葡萄糖碳重新導(dǎo)向各種合成代謝命運(yùn),而glargine對(duì)Atm-KO組中的葡萄糖命運(yùn)影響很小。

圖3 胰島素激活的ATM調(diào)控小腦中需氧糖酵解的關(guān)鍵調(diào)控因子
關(guān)于增強(qiáng)的谷氨酰胺依賴性,命運(yùn)追蹤顯示Atm-KO表現(xiàn)出固有的GABA生物合成貢獻(xiàn)減少,而其在線粒體中的氧化命運(yùn)增強(qiáng)。相反,在Atm-WT中,基線谷氨酰胺介導(dǎo)的GABA合成很高,但在glargine刺激后急劇減少。
Zebrin-II/ALDOC陽(yáng)性的Purkinje細(xì)胞依賴糖酵解,更容易受到ATM缺失導(dǎo)致的代謝重編程影響
靶向脂質(zhì)組學(xué)分析顯示,幾種脂肪酸、磷脂和鞘脂的豐度在Atm-KO中降低。免疫印跡分析進(jìn)一步支持了這一觀點(diǎn),揭示了Purkinje細(xì)胞標(biāo)志物(calbindin)的信號(hào)減少,但不是顆粒神經(jīng)元(NeuN)的標(biāo)志物。免疫組織學(xué)檢查證實(shí)了IP3R1+ Purkinje細(xì)胞數(shù)量、胞體直徑和攀緣纖維連接(VGlut2)的特定損失。
這些變化在小腦蚓部后葉(即小葉L6-L9)和絮結(jié)葉(即L10)中更為突出,這些區(qū)域與全身姿勢(shì)、運(yùn)動(dòng)和平衡有關(guān)。ALDOC水平在Atm-KO中更顯著降低,這種變化通過L7-L10小葉中ALDOC+ Purkinje細(xì)胞數(shù)量的類似減少模式得到進(jìn)一步驗(yàn)證。
核定位的PKM2共激活HIF1α——有氧糖酵解調(diào)節(jié)因子,重塑有利于葡萄糖向脂質(zhì)生物生成的合成代謝命運(yùn)的代謝景觀
研究人員在6月齡Atm-WT和Atm-KO小鼠中每天給予glargine劑量,持續(xù)四周,以模擬持續(xù)高胰島素血癥狀況。結(jié)果顯示,僅接受glargine或與TEPP-46聯(lián)合給藥的小鼠僅表現(xiàn)出輕微的葡萄糖處置受損跡象,但代償性高胰島素血癥和胰島素敏感性降低的跡象更加明顯。
在Atm-WT小鼠中,glargine單獨(dú)給藥觀察到的體重顯著增加在共同給予TEPP-46的情況下得到緩解,表明在代謝功能性PKM2四聚體存在的情況下,慢性胰島素的促合成代謝效應(yīng)被廢除。相反,由于ATM缺乏可以直接無效胰島素的合成代謝效應(yīng),這個(gè)年齡的Atm-KO小鼠本來就有胰島素不敏感,甚至可能在開始這個(gè)治療方案之前就被認(rèn)為是前驅(qū)糖尿病或糖尿病。
補(bǔ)充α-酮戊二酸——谷氨酰胺的α-酮酸,減輕ATM缺陷相關(guān)的內(nèi)源性谷氨酰胺浪費(fèi)和胰島素抵抗
研究發(fā)現(xiàn)ATM缺陷條件下,糖酵解不足引發(fā)了對(duì)氨基酸(特別是谷氨酰胺)作為線粒體替代碳源的代償性依賴。雖然谷氨酰胺的主要來源是骨骼肌,但持續(xù)分解蛋白質(zhì)以滿足身體對(duì)其作為燃料增加的需求可能導(dǎo)致瘦肌肉質(zhì)量減少,進(jìn)一步增加胰島素抵抗和其他代謝并發(fā)癥的風(fēng)險(xiǎn)和進(jìn)展。
α-KG作為谷氨酰胺/谷氨酸衍生的α-酮酸,在細(xì)胞碳和氮代謝之間作為關(guān)鍵連接點(diǎn)發(fā)揮重要作用。研究發(fā)現(xiàn)循環(huán)中的α-KG可以通過載體介導(dǎo)和被動(dòng)擴(kuò)散機(jī)制穿越血腦屏障。在靶細(xì)胞表面,結(jié)合形式的α-KG作為二價(jià)陰離子的跨膜運(yùn)輸可以通過鈉依賴性二羧酸轉(zhuǎn)運(yùn)蛋白有效促進(jìn)。
在體外小腦培養(yǎng)中引入重度標(biāo)記的1,2,3,4-13C4-α-KG有效地競(jìng)爭(zhēng)了重度標(biāo)記的13C5-U-谷氨酰胺作為線粒體燃料的參與,表明α-KG具有替代內(nèi)源性谷氨酰胺耗竭的潛在能力。組織氨水平也降低了,證實(shí)α-KG是一種危險(xiǎn)性較小但更有效的代謝補(bǔ)充替代品。
在體內(nèi)環(huán)境下,一項(xiàng)小型試點(diǎn)研究使用年輕Atm-KO小鼠首先評(píng)估了2%鈣α-KG(CaAKG)的安全性和耐受性。結(jié)果顯示,經(jīng)過相同持續(xù)時(shí)間飲食補(bǔ)充2% CaAKG的小鼠表現(xiàn)出更優(yōu)異的血糖控制結(jié)果?;谶@個(gè)試點(diǎn)結(jié)果,后續(xù)實(shí)驗(yàn)通過飲食補(bǔ)充方法將治療持續(xù)時(shí)間延長(zhǎng)至185天。
生存率分析顯示,從飲食中接受2% CaAKG的Atm-KO小鼠死亡率顯著降低,這種改善可能與增強(qiáng)的整體生長(zhǎng)有關(guān),表現(xiàn)為體長(zhǎng)增加和瘦骨骼肌質(zhì)量的更好保存。作為α-酮酸(RQ>1),CaAKG通過自身作為生物燃料克服了與碳水化合物利用效率低下相關(guān)的挑戰(zhàn)。
研究結(jié)論表明,胰島素激活的ATM觸發(fā)了一個(gè)獨(dú)特的磷酸化蛋白質(zhì)組網(wǎng)絡(luò),對(duì)于將葡萄糖代謝命運(yùn)從分解代謝轉(zhuǎn)變?yōu)楹铣纱x至關(guān)重要。當(dāng)ATM缺失時(shí),發(fā)生廣泛的代謝重編程,導(dǎo)致對(duì)氨基酸(尤其是谷氨酰胺)作為線粒體替代燃料源的代償性依賴。這些改變使胰島素敏感的Purkinje細(xì)胞容易受到與ATM缺陷相關(guān)的代謝變化影響,從而有助于A-T共濟(jì)失調(diào)和運(yùn)動(dòng)相關(guān)癥狀的發(fā)展。
該研究證明了補(bǔ)充α-酮戊二酸可以作為替代代謝物,減輕系統(tǒng)性谷氨酰胺依賴性、葡萄糖不耐受,同時(shí)解決與氨神經(jīng)毒性相關(guān)的問題。這些發(fā)現(xiàn)強(qiáng)調(diào)了外周代謝缺陷在A-T持續(xù)小腦變化發(fā)展中的重要作用,并為管理人類A-T和其他具有類似代謝挑戰(zhàn)的疾病提供了潛在治療靶點(diǎn)。
這項(xiàng)研究不僅揭示了ATM在胰島素信號(hào)和代謝調(diào)控中的新功能,還為理解外周代謝紊亂如何影響神經(jīng)系統(tǒng)健康提供了重要見解,為A-T的治療提供了新的代謝干預(yù)策略。
參考資料
[1] Alpha-ketoglutarate mitigates insulin resistance and metabolic inflexibility in a mouse model of Ataxia-Telangiectasia
摘要:研究揭示了ATM激酶作為胰島素信號(hào)通路關(guān)鍵介質(zhì)的新功能。
在罕見病研究領(lǐng)域,共濟(jì)失調(diào)毛細(xì)血管擴(kuò)張癥(Ataxia-Telangiectasia, A-T)一直是一個(gè)令人困惑的謎題。這種由ATM基因功能缺失突變引起的常染色體隱性遺傳病,不僅表現(xiàn)為進(jìn)行性小腦共濟(jì)失調(diào)和免疫缺陷,還伴隨著一系列令人費(fèi)解的代謝異常——生長(zhǎng)遲緩、肌肉萎縮、意外體重減輕,甚至在老年患者中出現(xiàn)血脂異常、葡萄糖不耐受、非酒精性脂肪肝和糖尿病等代謝合并癥。更令人驚訝的是,臨床研究發(fā)現(xiàn)胰島素抵抗與A-T患者小腦和運(yùn)動(dòng)功能的惡化密切相關(guān),這提示代謝紊亂可能是推動(dòng)神經(jīng)退行性變的關(guān)鍵因素。
長(zhǎng)期以來,ATM激酶主要被認(rèn)為在DNA損傷應(yīng)答中發(fā)揮核心作用,但越來越多的證據(jù)表明它也在代謝調(diào)控中扮演重要角色。胰島素作為調(diào)節(jié)營(yíng)養(yǎng)物質(zhì)吸收和代謝過程的關(guān)鍵激素,其信號(hào)通路與ATM之間存在著令人關(guān)注的交集。先前研究發(fā)現(xiàn)ATM是胰島素信號(hào)的下游介質(zhì),促進(jìn)胰島素刺激的葡萄糖代謝,但許多關(guān)鍵問題仍未解決:胰島素激活A(yù)TM的精確機(jī)制是什么?ATM是否在協(xié)調(diào)胰島素敏感細(xì)胞中分解代謝和合成代謝狀態(tài)之間的動(dòng)態(tài)轉(zhuǎn)換中發(fā)揮作用?為什么這些代謝紊亂主要導(dǎo)致A-T的共濟(jì)失調(diào)癥狀,而不是同樣與小腦損傷相關(guān)的認(rèn)知和精神疾病?

圖1 α-酮戊二酸緩解共濟(jì)失調(diào)-毛細(xì)血管擴(kuò)張癥小鼠模型的胰島素抵抗與代謝僵化
發(fā)表在《Nature Communications》的這項(xiàng)研究給出了令人振奮的答案。研究人員發(fā)現(xiàn)ATM缺失會(huì)導(dǎo)致全身性胰島素抵抗和代謝靈活性喪失,引發(fā)代償性的谷氨酰胺依賴性代謝重組。特別重要的是,他們發(fā)現(xiàn)胰島素敏感的小腦Purkinje細(xì)胞——尤其是那些表達(dá)Zebrin-II/ALDOC、在小腦蚓部后葉和絮結(jié)葉中解剖學(xué)豐富的細(xì)胞——對(duì)ATM缺失相關(guān)的代謝變化特別敏感。這種解剖學(xué)特異性易感性導(dǎo)致了A-T共濟(jì)失調(diào)和運(yùn)動(dòng)相關(guān)癥狀的發(fā)展。
研究團(tuán)隊(duì)證明補(bǔ)充α-酮戊二酸(α-ketoglutarate, α-KG)——谷氨酰胺的α-酮酸骨架——能夠減輕谷氨酰胺依賴性,減弱Purkinje細(xì)胞變性。這些發(fā)現(xiàn)表明外周代謝缺陷可能導(dǎo)致A-T中持續(xù)的神經(jīng)退行性變化,強(qiáng)調(diào)了在患者中篩查、監(jiān)測(cè)和解決這些代謝紊亂的重要性。
研究人員運(yùn)用了多種關(guān)鍵技術(shù)方法:使用Atm基因敲除(KO)小鼠模型進(jìn)行體內(nèi)代謝表型分析;通過間接熱量測(cè)定評(píng)估呼吸商(respiratory quotient, RQ)和代謝靈活性;采用穩(wěn)定同位素標(biāo)記的葡萄糖(13C6-U-glucose)和谷氨酰胺(13C5-U-glutamine)進(jìn)行代謝流分析;利用磷酸化蛋白質(zhì)組學(xué)分析胰島素刺激后的信號(hào)網(wǎng)絡(luò);通過免疫組織化學(xué)和免疫印跡評(píng)估蛋白表達(dá)和定位;使用單細(xì)胞RNA測(cè)序數(shù)據(jù)挖掘分析人和小鼠小腦細(xì)胞類型特異性表達(dá)譜。人源樣本來自Coriell醫(yī)學(xué)研究所的A-T患者成纖維細(xì)胞庫(kù)和小腦組織數(shù)據(jù)庫(kù)。
ATM缺失導(dǎo)致系統(tǒng)性胰島素抵抗和代謝不靈活性
研究人員首先在相當(dāng)于人類青春期(3月齡)和成年早期(6月齡)的Atm-KO小鼠中進(jìn)行了全面代謝分析。雖然年輕小鼠的物理參數(shù)沒有明顯差異,但在6月齡Atm-KO中觀察到明顯的生長(zhǎng)遲緩和體重減輕。通過Kraft測(cè)試評(píng)估葡萄糖耐受性(靜脈葡萄糖耐受測(cè)試, IGTT)和胰島素反應(yīng),發(fā)現(xiàn)3月齡小鼠雖然表現(xiàn)出接近正常的葡萄糖耐受性,但血漿胰島素譜升高表明存在前驅(qū)糖尿病胰島素抵抗。相比之下,大多數(shù)6月齡Atm-KO小鼠出現(xiàn)葡萄糖不耐受并伴有胰島素反應(yīng)受損,提示向2型糖尿病進(jìn)展。
間接熱量測(cè)定測(cè)試顯示,6月齡Atm-KO小鼠在光暗周期中都表現(xiàn)出持續(xù)、非波動(dòng)的呼吸商(RQ)值(0.8-0.9之間,表明蛋白質(zhì)分解代謝),而其他實(shí)驗(yàn)組在黑暗周期中表現(xiàn)出從蛋白質(zhì)/脂質(zhì)代謝向碳水化合物分解代謝(RQ=0.9-1)轉(zhuǎn)換的強(qiáng)大能力。這種因胰島素抵抗和糖尿病并發(fā)癥導(dǎo)致的代謝靈活性缺乏,耗盡了脂肪儲(chǔ)備和骨骼肌。

圖2 ATM缺陷引發(fā)高分解代謝表型
小腦Purkinje細(xì)胞對(duì)胰島素敏感且與外周胰島素抵抗功能相關(guān)
研究發(fā)現(xiàn)ATM在小腦皮層中的基因表達(dá)水平在出生前和出生后期間始終高于其他腦區(qū)域。胰島素受體(INSR)也表現(xiàn)出類似的表達(dá)模式。免疫組織化學(xué)分析顯示INSRβ和IRS1信號(hào)在Purkinje細(xì)胞(IP3R1+)中顯著存在,提示它們對(duì)來自外周循環(huán)的胰島素具有響應(yīng)性。
在體內(nèi)環(huán)境下,記錄IGTT引入血糖激增后的胰島素反應(yīng)時(shí)間動(dòng)態(tài)。通常,血漿胰島素水平升高持續(xù)時(shí)間約為2小時(shí),然后恢復(fù)到接近基線水平。在所有Atm-KO小鼠中,在IGTT啟動(dòng)前和啟動(dòng)后2小時(shí)檢測(cè)到腦脊液(CSF)中基礎(chǔ)和飽和胰島素濃度升高,這與其他前驅(qū)糖尿病模型中發(fā)現(xiàn)的現(xiàn)象相似。
功能上,運(yùn)動(dòng)和協(xié)調(diào)功能的行為評(píng)估與相應(yīng)的HOMA-IR指數(shù)顯示出負(fù)相關(guān)。這促使研究人員檢查從6月齡小鼠IGTT后2小時(shí)采集的小腦組織。Atm-KO組顯示胰島素抵抗的跡象,其特征是INSRβ的酪氨酸自磷酸化減少,同時(shí)IRS1的絲氨酸磷酸化增加。
ATM缺陷導(dǎo)致小腦糖酵解不足和向谷氨酰胺依賴轉(zhuǎn)變
全局代謝譜分析顯示,與"蛋氨酸代謝"和"甘氨酸和絲氨酸代謝"相關(guān)的代謝物在ATM缺失的情況下持續(xù)升高,而常見下調(diào)的代謝物主要涉及中央糖酵解網(wǎng)絡(luò)(如Warburg效應(yīng)、糖異生、糖酵解、果糖和甘露糖降解),提示糖酵解活性降低。參與多種脂質(zhì)生物合成途徑的代謝物也減少。
體外小腦培養(yǎng)的線粒體燃料依賴性分析顯示,從葡萄糖到谷氨酰胺作為主要呼吸燃料的顯著轉(zhuǎn)變。進(jìn)一步同位素示蹤分析表明,即使在未刺激條件下,葡萄糖向甘油-3-磷酸(G3P, M+3)和α-酮戊二酸(α-KG)(M+2, M+4來自第二輪TCA)的通量在Atm-KO中已經(jīng)受損。經(jīng)過2小時(shí)的glargine暴露,Atm-WT組迅速將葡萄糖碳重新導(dǎo)向各種合成代謝命運(yùn),而glargine對(duì)Atm-KO組中的葡萄糖命運(yùn)影響很小。

圖3 胰島素激活的ATM調(diào)控小腦中需氧糖酵解的關(guān)鍵調(diào)控因子
關(guān)于增強(qiáng)的谷氨酰胺依賴性,命運(yùn)追蹤顯示Atm-KO表現(xiàn)出固有的GABA生物合成貢獻(xiàn)減少,而其在線粒體中的氧化命運(yùn)增強(qiáng)。相反,在Atm-WT中,基線谷氨酰胺介導(dǎo)的GABA合成很高,但在glargine刺激后急劇減少。
Zebrin-II/ALDOC陽(yáng)性的Purkinje細(xì)胞依賴糖酵解,更容易受到ATM缺失導(dǎo)致的代謝重編程影響
靶向脂質(zhì)組學(xué)分析顯示,幾種脂肪酸、磷脂和鞘脂的豐度在Atm-KO中降低。免疫印跡分析進(jìn)一步支持了這一觀點(diǎn),揭示了Purkinje細(xì)胞標(biāo)志物(calbindin)的信號(hào)減少,但不是顆粒神經(jīng)元(NeuN)的標(biāo)志物。免疫組織學(xué)檢查證實(shí)了IP3R1+ Purkinje細(xì)胞數(shù)量、胞體直徑和攀緣纖維連接(VGlut2)的特定損失。
這些變化在小腦蚓部后葉(即小葉L6-L9)和絮結(jié)葉(即L10)中更為突出,這些區(qū)域與全身姿勢(shì)、運(yùn)動(dòng)和平衡有關(guān)。ALDOC水平在Atm-KO中更顯著降低,這種變化通過L7-L10小葉中ALDOC+ Purkinje細(xì)胞數(shù)量的類似減少模式得到進(jìn)一步驗(yàn)證。
核定位的PKM2共激活HIF1α——有氧糖酵解調(diào)節(jié)因子,重塑有利于葡萄糖向脂質(zhì)生物生成的合成代謝命運(yùn)的代謝景觀
研究人員在6月齡Atm-WT和Atm-KO小鼠中每天給予glargine劑量,持續(xù)四周,以模擬持續(xù)高胰島素血癥狀況。結(jié)果顯示,僅接受glargine或與TEPP-46聯(lián)合給藥的小鼠僅表現(xiàn)出輕微的葡萄糖處置受損跡象,但代償性高胰島素血癥和胰島素敏感性降低的跡象更加明顯。
在Atm-WT小鼠中,glargine單獨(dú)給藥觀察到的體重顯著增加在共同給予TEPP-46的情況下得到緩解,表明在代謝功能性PKM2四聚體存在的情況下,慢性胰島素的促合成代謝效應(yīng)被廢除。相反,由于ATM缺乏可以直接無效胰島素的合成代謝效應(yīng),這個(gè)年齡的Atm-KO小鼠本來就有胰島素不敏感,甚至可能在開始這個(gè)治療方案之前就被認(rèn)為是前驅(qū)糖尿病或糖尿病。
補(bǔ)充α-酮戊二酸——谷氨酰胺的α-酮酸,減輕ATM缺陷相關(guān)的內(nèi)源性谷氨酰胺浪費(fèi)和胰島素抵抗
研究發(fā)現(xiàn)ATM缺陷條件下,糖酵解不足引發(fā)了對(duì)氨基酸(特別是谷氨酰胺)作為線粒體替代碳源的代償性依賴。雖然谷氨酰胺的主要來源是骨骼肌,但持續(xù)分解蛋白質(zhì)以滿足身體對(duì)其作為燃料增加的需求可能導(dǎo)致瘦肌肉質(zhì)量減少,進(jìn)一步增加胰島素抵抗和其他代謝并發(fā)癥的風(fēng)險(xiǎn)和進(jìn)展。
α-KG作為谷氨酰胺/谷氨酸衍生的α-酮酸,在細(xì)胞碳和氮代謝之間作為關(guān)鍵連接點(diǎn)發(fā)揮重要作用。研究發(fā)現(xiàn)循環(huán)中的α-KG可以通過載體介導(dǎo)和被動(dòng)擴(kuò)散機(jī)制穿越血腦屏障。在靶細(xì)胞表面,結(jié)合形式的α-KG作為二價(jià)陰離子的跨膜運(yùn)輸可以通過鈉依賴性二羧酸轉(zhuǎn)運(yùn)蛋白有效促進(jìn)。
在體外小腦培養(yǎng)中引入重度標(biāo)記的1,2,3,4-13C4-α-KG有效地競(jìng)爭(zhēng)了重度標(biāo)記的13C5-U-谷氨酰胺作為線粒體燃料的參與,表明α-KG具有替代內(nèi)源性谷氨酰胺耗竭的潛在能力。組織氨水平也降低了,證實(shí)α-KG是一種危險(xiǎn)性較小但更有效的代謝補(bǔ)充替代品。
在體內(nèi)環(huán)境下,一項(xiàng)小型試點(diǎn)研究使用年輕Atm-KO小鼠首先評(píng)估了2%鈣α-KG(CaAKG)的安全性和耐受性。結(jié)果顯示,經(jīng)過相同持續(xù)時(shí)間飲食補(bǔ)充2% CaAKG的小鼠表現(xiàn)出更優(yōu)異的血糖控制結(jié)果?;谶@個(gè)試點(diǎn)結(jié)果,后續(xù)實(shí)驗(yàn)通過飲食補(bǔ)充方法將治療持續(xù)時(shí)間延長(zhǎng)至185天。
生存率分析顯示,從飲食中接受2% CaAKG的Atm-KO小鼠死亡率顯著降低,這種改善可能與增強(qiáng)的整體生長(zhǎng)有關(guān),表現(xiàn)為體長(zhǎng)增加和瘦骨骼肌質(zhì)量的更好保存。作為α-酮酸(RQ>1),CaAKG通過自身作為生物燃料克服了與碳水化合物利用效率低下相關(guān)的挑戰(zhàn)。
研究結(jié)論表明,胰島素激活的ATM觸發(fā)了一個(gè)獨(dú)特的磷酸化蛋白質(zhì)組網(wǎng)絡(luò),對(duì)于將葡萄糖代謝命運(yùn)從分解代謝轉(zhuǎn)變?yōu)楹铣纱x至關(guān)重要。當(dāng)ATM缺失時(shí),發(fā)生廣泛的代謝重編程,導(dǎo)致對(duì)氨基酸(尤其是谷氨酰胺)作為線粒體替代燃料源的代償性依賴。這些改變使胰島素敏感的Purkinje細(xì)胞容易受到與ATM缺陷相關(guān)的代謝變化影響,從而有助于A-T共濟(jì)失調(diào)和運(yùn)動(dòng)相關(guān)癥狀的發(fā)展。
該研究證明了補(bǔ)充α-酮戊二酸可以作為替代代謝物,減輕系統(tǒng)性谷氨酰胺依賴性、葡萄糖不耐受,同時(shí)解決與氨神經(jīng)毒性相關(guān)的問題。這些發(fā)現(xiàn)強(qiáng)調(diào)了外周代謝缺陷在A-T持續(xù)小腦變化發(fā)展中的重要作用,并為管理人類A-T和其他具有類似代謝挑戰(zhàn)的疾病提供了潛在治療靶點(diǎn)。
這項(xiàng)研究不僅揭示了ATM在胰島素信號(hào)和代謝調(diào)控中的新功能,還為理解外周代謝紊亂如何影響神經(jīng)系統(tǒng)健康提供了重要見解,為A-T的治療提供了新的代謝干預(yù)策略。
參考資料
[1] Alpha-ketoglutarate mitigates insulin resistance and metabolic inflexibility in a mouse model of Ataxia-Telangiectasia



