摘要:研究建立了首個能完整模擬從初始細胞命運決定到器官發(fā)生階段(E8.5-E8.75)的小鼠胚胎模型(iEFC-EM)。
胚胎發(fā)育研究一直是生命科學領域的重大課題,但現(xiàn)有胚胎模型存在效率低、發(fā)育階段有限、保真度不高等瓶頸問題。傳統(tǒng)方法需要混合多種干細胞或使用轉基因操作,不僅過程復雜,且難以真實模擬自然胚胎發(fā)育過程。特別是對于器官發(fā)生這一關鍵發(fā)育階段,現(xiàn)有模型更是難以完整重現(xiàn)。這些局限嚴重制約了發(fā)育生物學研究和再生醫(yī)學應用。
廣州國家實驗室的研究人員另辟蹊徑,開發(fā)了一種全新的研究策略。他們通過精心設計的小分子化合物組合,成功將小鼠胚胎干細胞(ESCs)直接重編程為具有多能性的8-16細胞樣胚胎祖細胞(iEFCs)。這些誘導獲得的胚胎祖細胞展現(xiàn)出驚人的發(fā)育潛力,能夠自主形成包含所有囊胚譜系的胚胎模型(iEFC-EM),并首次在體外完整重現(xiàn)了從初始細胞命運決定到器官發(fā)生的全過程。這項突破性研究成果發(fā)表在頂級期刊《Cell》上。

圖1 在化學誘導胚胎祖細胞支持下實現(xiàn)的小鼠胚胎發(fā)生至器官發(fā)生全過程模型
研究人員運用了多項關鍵技術:通過小分子化合物篩選建立高效誘導方案;采用單細胞RNA測序(scRNA-seq)分析細胞發(fā)育軌跡;利用轉座酶可及染色質測序(ATAC-seq)解析表觀遺傳調控機制;建立優(yōu)化的胚胎模型培養(yǎng)體系;通過免疫熒光染色和三維成像技術驗證模型發(fā)育特征。特別值得一提的是,研究還構建了從E1.5到E6.5的小鼠自然胚胎單細胞轉錄組參考數(shù)據(jù)集,為模型驗證提供了重要基準。
研究結果部分,文章通過系列實驗系統(tǒng)驗證了iEFC-EM模型的發(fā)育保真度:
"Screen identifies small molecules that reprogram ESCs into EFCs"顯示,優(yōu)化的K4處理方案(含CHIR99021、E616452和AM580)可高效誘導ESCs共表達OCT4、GATA6和CDX2,形成分子特征類似8-16細胞期胚胎的iEFCs。單細胞分析證實這些細胞與自然胚胎的轉錄組特征高度匹配。
"iEFCs segregate all blastocyst lineages both in vivo and in vitro"證實,iEFCs在體內外實驗中均能分化為所有囊胚譜系。嵌合實驗顯示iEFCs可貢獻到E6.5胚胎的所有胚層,而單細胞測序進一步驗證了其在胚胎和胚外組織中的均衡分布。
"iEFCs specify all blastocyst fates faithfully and rapidly"發(fā)現(xiàn),經過36小時的定向誘導,iEFCs可快速分化為上胚層(EPI)、原始內胚層(PrE)和滋養(yǎng)外胚層(TE),并形成具有極性TE和壁TE特征的復雜結構。
"iEFC-derived embryo model recapitulates embryo development faithfully"展示,iEFC-EM模型在8天內依次重現(xiàn)了譜系特化、腔體形成、對稱性打破、原腸形成等關鍵發(fā)育事件,最終形成具有14對體節(jié)、跳動心管、神經褶等器官發(fā)生期特征的胚胎樣結構。
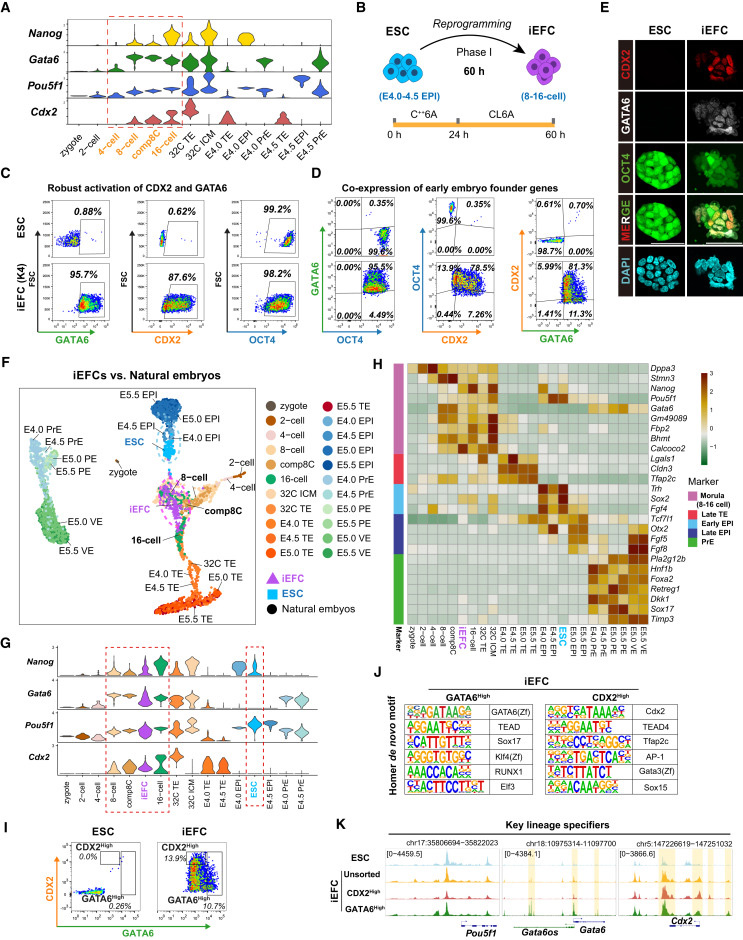
圖2 候選分子篩選鑒定出可將胚胎干細胞重編程為類胚胎祖細胞的小分子化合物
"Day-6 iEFC-EMs display high-fidelity E7.5 molecular signature"通過單細胞轉錄組分析證實,第6天的iEFC-EM與E7.5自然胚胎在分子特征上高度相似,包含24種細胞類型,重現(xiàn)了原條形成、上皮-間質轉化(EMT)等原腸胚形成過程。
"iEFC-EMs display advanced trophoblast lineage development"揭示,模型中的胚外組織發(fā)育同樣高度保真,不僅形成復雜的滋養(yǎng)層亞型,還能誘導子宮蛻膜化,提示其可能分泌未知的母體信號分子。
"iEFC-EMs reach organogenesis efficiently and with high fidelity"顯示,第8天的模型形成了包括前/中/后腦、心管、視泡、尾芽等器官原基,單細胞測序鑒定出20種胚胎和7種胚外細胞類型,其轉錄特征與E8.5自然胚胎高度一致。
"Neurulation and surface ectoderm development"證實,iEFC-EM的神經外胚層發(fā)育遵循自然胚胎的時空模式,正確表達了OTX2(前腦和中腦)、PAX6(前腦和后腦)等區(qū)域特異性標記。
"Somitogenesis, cardiogenesis and mesodermal development"顯示,模型中的體節(jié)發(fā)生、心臟發(fā)育等中胚層衍生物與自然胚胎相似,心管呈現(xiàn)正確的環(huán)化形態(tài)和收縮功能。
"Endoderm development and PGC progression"發(fā)現(xiàn),模型不僅形成明確的前腸和后腸結構,還產生了正在遷移的原始生殖細胞(PGCs),其分子特征與體內發(fā)育的PGCs高度一致。
這項研究在多個方面具有重要意義:首先,iEFC-EM模型首次實現(xiàn)了從干細胞到器官發(fā)生階段的完整胚胎發(fā)育過程模擬,為研究早期發(fā)育機制提供了全新工具;其次,完全化學小分子誘導的策略避免了轉基因操作,更具應用潛力;再者,模型的高效率(54.2%達到器官發(fā)生階段)和可擴展性使其適合大規(guī)模篩選應用。特別值得注意的是,研究揭示了胚胎可能通過特定信號分子主動參與母體蛻膜化過程,這一發(fā)現(xiàn)為理解胚胎-母體對話提供了新線索。
盡管iEFC-EM模型在發(fā)育保真度上取得重大突破,作者也指出了當前局限:模型缺乏與子宮壁接觸的壁TE結構,這可能是其難以突破E8.5發(fā)育階段的關鍵因素。未來研究需要進一步優(yōu)化培養(yǎng)條件,解析維持后期發(fā)育的母體信號,以充分發(fā)揮這一系統(tǒng)的應用潛力。這項研究不僅為發(fā)育生物學研究樹立了新標桿,也為器官再生、疾病建模和生殖醫(yī)學等領域帶來了新的可能性。
參考資料
[1] A complete model of mouse embryogenesis through organogenesis enabled by chemically induced embryo founder cells
摘要:研究建立了首個能完整模擬從初始細胞命運決定到器官發(fā)生階段(E8.5-E8.75)的小鼠胚胎模型(iEFC-EM)。
胚胎發(fā)育研究一直是生命科學領域的重大課題,但現(xiàn)有胚胎模型存在效率低、發(fā)育階段有限、保真度不高等瓶頸問題。傳統(tǒng)方法需要混合多種干細胞或使用轉基因操作,不僅過程復雜,且難以真實模擬自然胚胎發(fā)育過程。特別是對于器官發(fā)生這一關鍵發(fā)育階段,現(xiàn)有模型更是難以完整重現(xiàn)。這些局限嚴重制約了發(fā)育生物學研究和再生醫(yī)學應用。
廣州國家實驗室的研究人員另辟蹊徑,開發(fā)了一種全新的研究策略。他們通過精心設計的小分子化合物組合,成功將小鼠胚胎干細胞(ESCs)直接重編程為具有多能性的8-16細胞樣胚胎祖細胞(iEFCs)。這些誘導獲得的胚胎祖細胞展現(xiàn)出驚人的發(fā)育潛力,能夠自主形成包含所有囊胚譜系的胚胎模型(iEFC-EM),并首次在體外完整重現(xiàn)了從初始細胞命運決定到器官發(fā)生的全過程。這項突破性研究成果發(fā)表在頂級期刊《Cell》上。

圖1 在化學誘導胚胎祖細胞支持下實現(xiàn)的小鼠胚胎發(fā)生至器官發(fā)生全過程模型
研究人員運用了多項關鍵技術:通過小分子化合物篩選建立高效誘導方案;采用單細胞RNA測序(scRNA-seq)分析細胞發(fā)育軌跡;利用轉座酶可及染色質測序(ATAC-seq)解析表觀遺傳調控機制;建立優(yōu)化的胚胎模型培養(yǎng)體系;通過免疫熒光染色和三維成像技術驗證模型發(fā)育特征。特別值得一提的是,研究還構建了從E1.5到E6.5的小鼠自然胚胎單細胞轉錄組參考數(shù)據(jù)集,為模型驗證提供了重要基準。
研究結果部分,文章通過系列實驗系統(tǒng)驗證了iEFC-EM模型的發(fā)育保真度:
"Screen identifies small molecules that reprogram ESCs into EFCs"顯示,優(yōu)化的K4處理方案(含CHIR99021、E616452和AM580)可高效誘導ESCs共表達OCT4、GATA6和CDX2,形成分子特征類似8-16細胞期胚胎的iEFCs。單細胞分析證實這些細胞與自然胚胎的轉錄組特征高度匹配。
"iEFCs segregate all blastocyst lineages both in vivo and in vitro"證實,iEFCs在體內外實驗中均能分化為所有囊胚譜系。嵌合實驗顯示iEFCs可貢獻到E6.5胚胎的所有胚層,而單細胞測序進一步驗證了其在胚胎和胚外組織中的均衡分布。
"iEFCs specify all blastocyst fates faithfully and rapidly"發(fā)現(xiàn),經過36小時的定向誘導,iEFCs可快速分化為上胚層(EPI)、原始內胚層(PrE)和滋養(yǎng)外胚層(TE),并形成具有極性TE和壁TE特征的復雜結構。
"iEFC-derived embryo model recapitulates embryo development faithfully"展示,iEFC-EM模型在8天內依次重現(xiàn)了譜系特化、腔體形成、對稱性打破、原腸形成等關鍵發(fā)育事件,最終形成具有14對體節(jié)、跳動心管、神經褶等器官發(fā)生期特征的胚胎樣結構。

圖2 候選分子篩選鑒定出可將胚胎干細胞重編程為類胚胎祖細胞的小分子化合物
"Day-6 iEFC-EMs display high-fidelity E7.5 molecular signature"通過單細胞轉錄組分析證實,第6天的iEFC-EM與E7.5自然胚胎在分子特征上高度相似,包含24種細胞類型,重現(xiàn)了原條形成、上皮-間質轉化(EMT)等原腸胚形成過程。
"iEFC-EMs display advanced trophoblast lineage development"揭示,模型中的胚外組織發(fā)育同樣高度保真,不僅形成復雜的滋養(yǎng)層亞型,還能誘導子宮蛻膜化,提示其可能分泌未知的母體信號分子。
"iEFC-EMs reach organogenesis efficiently and with high fidelity"顯示,第8天的模型形成了包括前/中/后腦、心管、視泡、尾芽等器官原基,單細胞測序鑒定出20種胚胎和7種胚外細胞類型,其轉錄特征與E8.5自然胚胎高度一致。
"Neurulation and surface ectoderm development"證實,iEFC-EM的神經外胚層發(fā)育遵循自然胚胎的時空模式,正確表達了OTX2(前腦和中腦)、PAX6(前腦和后腦)等區(qū)域特異性標記。
"Somitogenesis, cardiogenesis and mesodermal development"顯示,模型中的體節(jié)發(fā)生、心臟發(fā)育等中胚層衍生物與自然胚胎相似,心管呈現(xiàn)正確的環(huán)化形態(tài)和收縮功能。
"Endoderm development and PGC progression"發(fā)現(xiàn),模型不僅形成明確的前腸和后腸結構,還產生了正在遷移的原始生殖細胞(PGCs),其分子特征與體內發(fā)育的PGCs高度一致。
這項研究在多個方面具有重要意義:首先,iEFC-EM模型首次實現(xiàn)了從干細胞到器官發(fā)生階段的完整胚胎發(fā)育過程模擬,為研究早期發(fā)育機制提供了全新工具;其次,完全化學小分子誘導的策略避免了轉基因操作,更具應用潛力;再者,模型的高效率(54.2%達到器官發(fā)生階段)和可擴展性使其適合大規(guī)模篩選應用。特別值得注意的是,研究揭示了胚胎可能通過特定信號分子主動參與母體蛻膜化過程,這一發(fā)現(xiàn)為理解胚胎-母體對話提供了新線索。
盡管iEFC-EM模型在發(fā)育保真度上取得重大突破,作者也指出了當前局限:模型缺乏與子宮壁接觸的壁TE結構,這可能是其難以突破E8.5發(fā)育階段的關鍵因素。未來研究需要進一步優(yōu)化培養(yǎng)條件,解析維持后期發(fā)育的母體信號,以充分發(fā)揮這一系統(tǒng)的應用潛力。這項研究不僅為發(fā)育生物學研究樹立了新標桿,也為器官再生、疾病建模和生殖醫(yī)學等領域帶來了新的可能性。
參考資料
[1] A complete model of mouse embryogenesis through organogenesis enabled by chemically induced embryo founder cells



